




 优百分课时互动系列答案
优百分课时互动系列答案 开心蛙状元作业系列答案
开心蛙状元作业系列答案科目:高中化学 来源: 题型:
| A、用坩埚钳夹住铁丝在酒精灯上加热红热,迅速伸进氧气瓶中,燃烧火星四射,放出大量的热,生成红棕色的固体 |
| B、钠可以与冷水反应生成碱和氢气,铁必须与水蒸气反应才能生成碱和氢气 |
| C、相同物质的量的钠在常温和加热的条件下与氧气反应所得的产物不同,但转移的电子数相同 |
| D、等物质的量的铝分别与足量的盐酸和NaOH溶液反应,生成相同条件下氢气的体积比为1:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
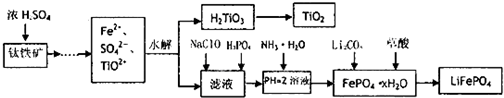
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
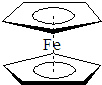 过渡金属元素及其化合物的应用研究是目前科学研究的前沿之一.试回答下列问题:
过渡金属元素及其化合物的应用研究是目前科学研究的前沿之一.试回答下列问题:| 电离能/kJ?mol-1 | I1 | I2 |
| 铜 | 746 | 1958 |
| 锌 | 906 | 1733 |
| 2 |
| 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 编号 | a的取值范围 | 产物的化学式或(离子符号) | ||||
| A | I2,Br- | |||||
| B |
| |||||
| C | ||||||
| D | I2,IO3-,Br2 | |||||
| E |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①>②>③ |
| B、③>①>② |
| C、②>①>③ |
| D、③>②>① |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com