
【题目】醋酸亚铬水合物{[Cr(CH3COO)2]22H2O,相对分子质量为376}是一种深红色晶体,不溶于冷水,是常用的氧气吸收剂,实验室中以锌粒,三氯化铬溶液、醋酸钠溶液和盐酸为主要原料制备醋酸亚铬水合物,其装置如图所示,且仪器2中预先加入锌粒,已知二价铬不稳定,极易被氧气氧化,不与锌反应.制备过程中发生的相关反应如下:
Zn(s)+2HCl(aq)═ZnCl2(aq)+H2(g)
2CrCl3(aq)+Zn(s)═2CrCl2(aq)+ZnCl2(aq)
2Cr2+(aq)+4CH3COO﹣(aq)+2H2O(l)═[Cr(CH3COO)2]22H2O(s)
请回答下列问题:
(1)仪器1的名称是 .
(2)往仪器2中加盐酸和三氯化铬溶液的顺序最好是(选下面的A、B或C);目的是 .
A.盐酸和三氯化铬溶液同时加入 B.先加三氯化铬溶液一段时间后再加盐酸C.先加盐酸一段时间后再加三氯化铬溶液
(3)为使生成的CrCl2溶液与CH3COONa溶液顺利混合,应关闭阀门(填“A”或“B”,下同),打开阀门 .
(4)本实验中锌粒要过量,其原因除了让产生的H2将CrCl2溶液压入装置3与CH3COONa溶液反应外,另一个作用是 .
(5)已知其它反应物足量,实验时取用的CrCl3溶液中含溶质9.51g,取用的醋酸钠溶液为1.5L0.1mol/L;实验后得干燥纯净的[Cr(CH3COO)2]22H2O9.4g,则该实验所得产品的产率为(不考虑溶解的醋酸亚铬水合物).
(6)铬的离子会污染水,常温下要除去上述实验中多余的Cr2+ , 最好往废液中通入足量的,再加入碱液,调节pH至少为才能使铬的离子沉淀完全(铬的离子浓度应小于10﹣5mol/L).【已知Cr(OH)3的溶度积为6.3×10﹣31 , ![]() ≈4,lg2≈0.3】
≈4,lg2≈0.3】
【答案】
(1)分液漏斗
(2)C;让锌粒与盐酸先反应产生H2,把装置2和3中的空气赶出,避免生成的亚铬离子被氧化
(3)B;A
(4)过量的锌与CrCl3充分反应得到CrCl2
(5)83.3%
(6)5.6
【解析】解:(1)根据仪器结构特征,可知仪器1为分液漏斗,盛装稀盐酸,盛装的稀盐酸与锌反应生成氢气,用来增大压强把生成的CrCl2溶液压入装置3中,
所以答案是:分液漏斗;(2)二价铬不稳定,极易被氧气氧化,让锌粒与盐酸先反应产生H2 , 让锌粒与盐酸先反应产生H2 , 把装置2和3中的空气赶出,避免生成的亚铬离子被氧化,故先加盐酸一段时间后再加三氯化铬溶液,所以答案是:C;让锌粒与盐酸先反应产生H2 , 把装置2和3中的空气赶出,避免生成的亚铬离子被氧化;(3)利用生成氢气,使装置内气体增大,将CrCl2溶液压入装置3中与CH3COONa溶液顺利混合,应关闭阀门B,打开阀门A,所以答案是:B;A;(4)锌粒要过量,其原因除了让产生的H2将CrCl2溶液压入装置3与CH3COONa溶液反应外,另一个作用是:过量的锌与CrCl3充分反应得到CrCl2 ,
所以答案是:过量的锌与CrCl3充分反应得到CrCl2;(5)CrCl3为n= ![]() =
= ![]() =0.06mol,得到CrCl2为0.06mol,而CH3COONa为1.5mol,由方程式2Cr2+(aq)+4CH3COO﹣(aq)+2H2O(l)═[Cr(CH3COO)2]22H2O(s)可知CH3COONa足量,则得到[Cr(CH3COO)2]22H2O为0.06mol×
=0.06mol,得到CrCl2为0.06mol,而CH3COONa为1.5mol,由方程式2Cr2+(aq)+4CH3COO﹣(aq)+2H2O(l)═[Cr(CH3COO)2]22H2O(s)可知CH3COONa足量,则得到[Cr(CH3COO)2]22H2O为0.06mol× ![]() ×376g/mol=11.28g,
×376g/mol=11.28g,
所得产品的产率为: ![]() ×100%=83.3%,所以答案是:83.3%;(6)除去废水中的Cr2+ , 可先通入氧气或空气,将Cr2+氧化为Cr3+ , 然后加入碱液调节溶液的pH,要使铬的离子沉淀完全,c(Cr3+)<10﹣5mol/L,则c(OH﹣)=
×100%=83.3%,所以答案是:83.3%;(6)除去废水中的Cr2+ , 可先通入氧气或空气,将Cr2+氧化为Cr3+ , 然后加入碱液调节溶液的pH,要使铬的离子沉淀完全,c(Cr3+)<10﹣5mol/L,则c(OH﹣)= ![]() mol/L=4×10﹣9mol/L,pH=﹣lg(
mol/L=4×10﹣9mol/L,pH=﹣lg( ![]() )=5.6,
)=5.6,
所以答案是:空气或氧气;5.6.


科目:高中化学 来源: 题型:
【题目】钢铁发生电化学腐蚀时,负极发生的反应是( )
A.2H++2e﹣═H2
B.2H2O+O2+4e﹣═4OH﹣
C.Fe﹣2e﹣═Fe2+
D.4OH﹣+4e﹣═2H2O+O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由乙炔为原料制取CHClBr﹣CH2Br,下列方法中最可行的是( )
A.先与HBr加成后再与HCl加成
B.先与H2完全加成后再与Cl2、Br2取代
C.先与HCl加成后再与Br2加成
D.先与Cl2加成后再与HBr加成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丙烯腈(CH2=CHCN)是一种重要的化工原料,工业上可用“丙烯氨氧化法”生产,主要副产物有丙烯醛(CH2=CHCHO)和乙腈(CH3CN)等,回答下列问题:
(1)以丙烯、氨、氧气为原料,在催化剂存在下生成丙烯腈(C3H3N)和副产物丙烯醛(C3H4O)的热化学方程式如下:
C3H6(g)+NH3(g)+ ![]() O2(g)=C3H3N(g)+3H2O(g)△H=﹣515kJ/mol
O2(g)=C3H3N(g)+3H2O(g)△H=﹣515kJ/mol
C3H6(g)+O2(g)=C3H4O(g)+H2O(g)△H=﹣353kJ/mol
两个反应在热力学上趋势均很大,其原因是;有利于提高丙烯腈平衡产率的反应条件是;提高丙烯腈反应选择性的关键因素是 .
(2)图(a)为丙烯腈产率与反应温度的关系曲线,最高产率对应温度为460℃.低于460℃时,丙烯腈的产率(填“是”或者“不是”)对应温度下的平衡
产率,判断理由是;高于460℃时,丙烯腈产率降低的可能原因是(双选,填标号)
A.催化剂活性降低 B.平衡常数变大 C.副反应增多 D.反应活化能增大
(3)丙烯腈和丙烯醛的产率与n(氨)/n(丙烯)的关系如图(b)所示.由图可知,最佳n(氨)/n(丙烯)约为 , 理由是 . 进料气氨、空气、丙烯的理论体积比约为
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求书写名称或结构简式:
(1)羟基的电子式;
(2)﹣C3H7结构简式:、;
(3)![]() 的系统命名为;
的系统命名为;
(4)相对分子质量为72且支链最多的烷烃的结构简式
(5)键线式 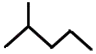 表示的分子式;名称是 .
表示的分子式;名称是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是某烃A分子的球棍模型.回答下列问题:
(1)A的名称是;
(2)A能够发生的反应类型有(填序号);
a.氧化反应 b.加成反应 c.消去反应
(3)A与溴的四氯化碳溶液反应的化学方程式是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将 4mol A 气体和 2mol B 气体在 2L 的容器中混合并在一定条件下发生如下反应:
2A(g)+B(g)3C(g)+4D(s),若经 2s后测得 C 的浓度为 0.9molL﹣1 , 现有下列几种说法:
①用物质 A 表示的反应的平均速率为 0.3molL﹣1s﹣1
②用物质 D 表示的反应的平均速率为 0.6molL﹣1s﹣1
③2s 时物质 A 的转化率为30%
④用A、B、C来表示反应速率,其速率之比=2:1:3
其中正确的是( )
A.①③④
B.①②③④
C.①②③
D.③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA代表阿伏加德罗常数的数值,则下列说法正确的是( )
A.1.8 g D2O含有NA个中子
B.用5 mL 3 mol/L FeCl3溶液制成的氢氧化铁胶体中所含胶粒数为0.015 NA
C.在Na2O2与CO2的反应中,每转移NA个电子时,消耗22.4 L的CO2
D.25℃时,7 g C2H4和C3H6的混合气体中,含有NA个C﹣H键
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com