
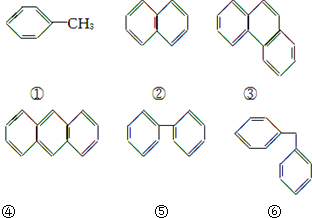
| A. | ①⑤ | B. | ②④ | C. | ④⑤ | D. | ⑤⑥ |
分析 有机物分子核磁共振氢谱中给出的信号峰数目相同,说明含有的H原子种类相同,结合有机物的结构的对称性解答该题.
解答 解:①为甲苯,苯环有3种,甲基1种,共4种H;
②左右、上下结构对称,有2种H;
③左右对称,有5种H;
④左右、上下结构对称,有3种H;
⑤两个苯环相同,每个苯环都有邻、间、对3种位置,有3种H;
⑥两个苯环相同,每个苯环都有邻、间、对3种位置,烃基有1种,共4种,
则①⑥、④⑤核磁共振氢谱中给出的信号峰数目相同.
故选C.
点评 本题考查了有机物结构与性质,为高频考点,题目难度大,明确核磁共振氢谱中峰的含义是解答本题的关键,要求学生掌握常见有机物的结构特点,从结构的对称性的角度解答该题.


科目:高中化学 来源: 题型:解答题
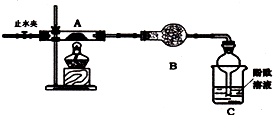

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验时酸或碱溅到眼中,应立即用水冲洗,并不断眨眼,不能用手搓揉眼睛 | |
| B. | 检验硫酸亚铁铵溶液中Fe2+的方法是:先滴加新制氨水后滴加KSCN溶液 | |
| C. | 证明钢铁吸收氧腐蚀的方法是:在镀锌铁皮上滴1~3滴含酚酞的饱和食盐水,静置1~2min,观察现象 | |
| D. | 因为氧化铁是一种碱性氧化物,所以常用作红色油漆和涂料 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
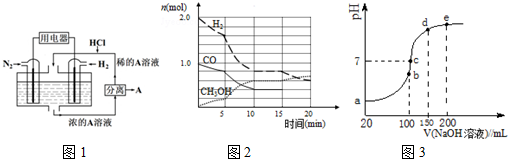
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原电池放电时正极反应为VO2++2H++e-═VO2++H2O | |
| B. | 充电时阴极反应为V2+-e-═V3+ | |
| C. | 电解池的阴极反应式为3O2+6H2O+6e-═3H2O2+6OH- | |
| D. | 电解池中生成22.4 L O3(标准状况)时,转移3 mol电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3.36L | B. | 1.12L | C. | 2.24L | D. | 4.48L |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
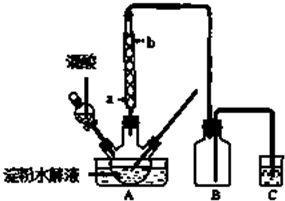
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com