
| A. | 1-戊醇 | B. | 3-戊醇 | ||
| C. | 2,2-二甲基-1-丙醇 | D. | 2-甲基-2-丁醇 |
分析 先书写戊基-C5H11异构体,戊基异构数目等于戊醇的异构体数目,再根据题干信息分子式为C5H12O的某醇与溴化钠、硫酸混合加热得卤代烃,该卤代烃不能发生消去反应,则醇也不能发生消去反应,说明与羟基相连的碳原子的相邻碳原子上不含H原子,据此确定该醇.
解答 解:化学式为C5H12O的醇有:OHCH2CH2CH2CH2CH3、OHCH(CH3)CH2CH2CH3、OHCH(CH2CH3)2、OHCH2CH(CH3)CH2CH3、OHC(CH3)2CH2CH3、OHCH(CH3)CH(CH3)2、OHCH2CH2CH(CH3)2、OHCH2C(CH3)3,分子式为C5H12O的某醇与溴化钠、硫酸混合加热得卤代烃,该卤代烃不能发生消去反应,则醇也不能发生消去反应,说明与羟基相连的碳原子的相邻碳原子上不含H原子;与羟基相连的碳原子的相邻碳原子上不含H原子,则中间的碳原子中连接3个-CH3和一个-CH2OH,所以其结构简式为(CH3)3CCH2OH,其名称为:2,2-二甲基-1-丙醇,
故选C.
点评 本题考查了醇和卤代烃的消去反应,注意醇发生消去反应的结构特点是:与羟基相连的碳原子的相邻碳原子上不含H原子,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
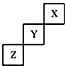
| A. | Y的单质的熔点比Z的低 | |
| B. | Y的最高正化合价为+5 | |
| C. | Z的氢化物的稳定性比Y的强 | |
| D. | X、Y、Z三种元素中,单质在常温下均为气态 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 晶体根据结构和性质只可分为分子晶体、原子晶体、离子晶体和金属晶体四大类 | |
| B. | 任何晶体中都含有化学键,如离子键、共价键、金属键、氢键等 | |
| C. | 含有阳离子的晶体一定是离子晶体 | |
| D. | 干冰和冰都属于分子晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
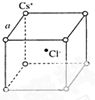 根据已学知识,请你回答下列问题:
根据已学知识,请你回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
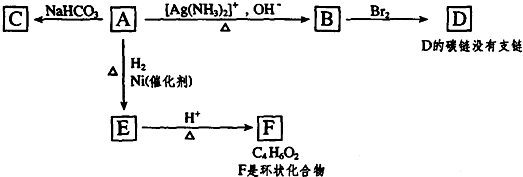
 .
.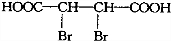 .
.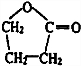 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ca(HCO3)2溶液与过量Ca(OH)2溶液反应:Ca2++HCO3-+OH-═CaCO3↓+H2O | |
| B. | 用惰性电极电解MgCl2溶液:2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$H2↑+Cl2↑+2OH- | |
| C. | 氯气通入水中:C12+H2O═2H++C1-+C1O- | |
| D. | 亚硫酸钡与稀硝酸反应:BaSO3+2H+═Ba2++SO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
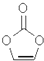
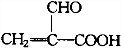
| A. | 分子式为C3H4O3 | B. | 分子中含8个σ键 | ||
| C. | 分子中只有极性键 | D. | 8.6g该物质完全燃烧得到6.72LCO2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com