
【题目】恒温下,将a mol N2与b mol H2的混合气体通入一个V升固定容积的密闭容器中,发生如下反应:N2 (g)+3H2(g)═2NH3(g)
(1)若反应进行到t分钟时,nt(N2)=13mol,nt(NH3)=6mol,计算a= , 反应速率V(H2)=molL﹣1min﹣1 .
(2)下列描述中能表明反应已达到平衡状态的是 ①混合气体的压强不变 ②混合气体的密度不变 ③混合气体的平均摩尔质量不变
④容器内N2 , H2 , NH3的浓度之比为1:3:2 ⑤单位时间内生成n mol NH3 , 同时生成N2 , H2共2n mol
(3)反应达平衡时,混合气体的体积为716.8L(标况下),其中NH3的含量(体积分数)为25%.计算平衡时NH3的物质的量n(NH3)=mol,N2和H2的转化率之比,α(N2):α(H2)= . (写最简整数比)
【答案】
(1)16;![]()
(2)③
(3)8;1:2
【解析】解:(1)反应进行到t时,测的N2为13mol,NH3为6mol,由方程式可知,参加反应的氮气的物质的量为:6mol× ![]() =3mol,故氮气的起始物质的量为:13mol+3mol=16mol,即a=16; nt(NH3)=6mol,则用氨气表示的平均反应速率为:v(NH3)=
=3mol,故氮气的起始物质的量为:13mol+3mol=16mol,即a=16; nt(NH3)=6mol,则用氨气表示的平均反应速率为:v(NH3)= ![]() =
= ![]() molL﹣1min﹣1 , 根据反应速率与化学计量数成正比可知,v(H2)=
molL﹣1min﹣1 , 根据反应速率与化学计量数成正比可知,v(H2)= ![]() v(NH3)=
v(NH3)= ![]() molL﹣1min﹣1 ,
molL﹣1min﹣1 ,
所以答案是:16; ![]() ;(2)①该反应为气体体积缩小的反应,反应过程中压强发生变化,当混合气体的压强不变时,表明正逆反应速率相等,达到了平衡状态,故①错误;②反应前后气体的体积和总质量不变,则混合气体的密度始终不变,不能根据密度判断平衡状态,故②错误;③该反应气体的总质量不变,气体总物质的量发生变化,则混合气体的平均摩尔质量发生变化,当平均摩尔质量不变时,表明该反应已经达到平衡状态,故③正确;④容器内N2 , H2 , NH3的浓度之比为1:3:2,无法判断各组分的浓度是否变化,则无法判断是否达到平衡状态,故④错误;⑤单位时间内生成n mol NH3 , 同时生成N2 , H2共2n mol,无法判断氮气、氢气的物质的量,则无法判断平衡状态,故⑤错误;
;(2)①该反应为气体体积缩小的反应,反应过程中压强发生变化,当混合气体的压强不变时,表明正逆反应速率相等,达到了平衡状态,故①错误;②反应前后气体的体积和总质量不变,则混合气体的密度始终不变,不能根据密度判断平衡状态,故②错误;③该反应气体的总质量不变,气体总物质的量发生变化,则混合气体的平均摩尔质量发生变化,当平均摩尔质量不变时,表明该反应已经达到平衡状态,故③正确;④容器内N2 , H2 , NH3的浓度之比为1:3:2,无法判断各组分的浓度是否变化,则无法判断是否达到平衡状态,故④错误;⑤单位时间内生成n mol NH3 , 同时生成N2 , H2共2n mol,无法判断氮气、氢气的物质的量,则无法判断平衡状态,故⑤错误;
所以答案是:③;(3)反应达平衡时,混合气体为: ![]() =32mol,其中NH3的物质的量为:32mol×25%=8mol;
=32mol,其中NH3的物质的量为:32mol×25%=8mol;
利用差量法计算:
N2(g)+ | 3H2(g) | 2NH3(g) | 物质的量减少△n | ||
1mol | 3mol | 2mol | 2mol | ||
转化: | 4mol | 12mol | 8mol | 8mol |
故原混合气体为:32mol+8mol=40mol,
由(1)知a=16mol,则b=40mol﹣16mol=24mol,
达到平衡时,N2和H2的转化率之比α(N2):α(H2)= ![]() :
: ![]() =1:2,
=1:2,
所以答案是:1:2.
【考点精析】本题主要考查了化学平衡的计算的相关知识点,需要掌握反应物转化率=转化浓度÷起始浓度×100%=转化物质的量÷起始物质的量×100%;产品的产率=实际生成产物的物质的量÷理论上可得到产物的物质的量×100%才能正确解答此题.


 能力评价系列答案
能力评价系列答案 唐印文化课时测评系列答案
唐印文化课时测评系列答案科目:高中化学 来源: 题型:
【题目】(14分)砷(As)是第四周期ⅤA族元素,可以形成As2S3、As2O5、H3AsO3、H3AsO4等化合物,有着广泛的用途.回答下列问题:
(1)画出砷的原子结构示意图 .
(2)工业上常将含砷废渣(主要成分为As2S3)制成浆状,通入O2氧化,生成H3AsO4和单质硫.写出发生反应的化学方程式 . 该反应需要在加压下进行,原因是 .
(3)已知:As(s)+ ![]() H2(g)+2O2(g)=H3AsO4(s)△H1
H2(g)+2O2(g)=H3AsO4(s)△H1
H2(g)+ ![]() O2(g)=H2O(l)△H2
O2(g)=H2O(l)△H2
2As(s)+ ![]() O2(g)=As2O5(s)△H3
O2(g)=As2O5(s)△H3
则反应As2O5(s)+3H2O(l)=2H3AsO4(s)的△H= .
(4)298K时,将20mL 3x molL﹣1 Na3AsO3、20mL 3x molL﹣1 I2和20mL NaOH溶液混合,发生反应:AsO33﹣(aq)+I2(aq)+2OH﹣AsO43﹣(aq)+2I﹣(aq)+H2O(l).溶液中c(AsO43﹣)与反应时间(t)的关系如图所示.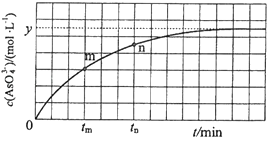
①下列可判断反应达到平衡的是(填标号).
a.溶液的pH不再变化
b.v(I﹣)=2v(AsO33﹣)
c.c (AsO43﹣)/c (AsO33﹣)不再变化
d.c(I﹣)=y molL﹣1
②tm时,v正 v逆(填“大于”“小于”或“等于”).
③tm时v逆tn时v逆(填“大于”“小于”或“等于”),理由是 .
④若平衡时溶液的pH=14,则该反应的平衡常数K为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家最近在-100℃的低温下合成了一种烃X,X分子中所有氢原子的化学环境没有区别,其球棍模型如图。下列说法中不正确的是

A. X的分子式为C5H4
B. X分子中有碳碳单键,也有碳碳双键
C. 该烃X与等质量的甲烷相比,X燃烧时消耗的氧气更多
D. X分子中的氢原子分布在两个相互垂直的异面直线上
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据问题填空:
(1)下列原子: ![]() C、147N、
C、147N、 ![]() Na、
Na、 ![]() H、
H、 ![]() U、
U、 ![]() K、
K、 ![]() U中共有种元素,种核素,和互为同位素.
U中共有种元素,种核素,和互为同位素.
(2)下列曲线分别表示元素的某种性质与核电荷数的关系(X为核电荷数,Y为元素的 有关性质).把与下面元素有关的性质相符的曲线标号填入相应的空格中: 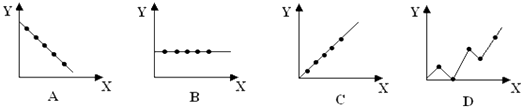
② 第ⅡA族元素的最外层电子数;
②第三周期元素的最高化合价;
③碱金属单质的熔点
(3)阴离子的中子数为N:AXn﹣共有x个电子,则N= .
(4)有下列物质中NH3、Na2O、CO2、CaCl2、CCl4、N2、NaHCO3、NaOH、Na2O2、NH4Cl属于电解质的有 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D四种元素,原子序数依次增大,A原子的最外层上有4个电子;B的阴离子和C的阳离子具有相同的电子层结构,两元素的单质反应,生成一种淡黄色的固体E,D的L层电子数等于K、M两个电子层上的电子数之和.
(1)A为 ,B为 ,C为 .
(2)E的电子式为 .
(3)写出D的最高价氧化物的水化物和A单质反应的化学方程式
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组用下列装置进行乙醇催化氧化的实验. 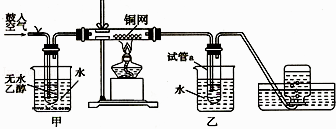
(1)实验过程中铜网出现黑色和红色交替的现象. ①红色变成黑色的反应是:2Cu+O22CuO;
②黑色变为红色的化学方程式为: .
在不断鼓入空气的情况下,熄灭酒精灯,反应仍能继续进行,说明该乙醇催化反应是反应.
(2)甲和乙两个水浴作用不相同.甲的作用是;乙的作用是 .
(3)反应进行一段时间后,试管a中能收集到多种物质,它们是 . (任写两种即可)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数的值,下列叙述正确的是( )
A.将1 mol Cl2通入到水中,则N(HClO)+N(Cl﹣)+N(ClO﹣)=2NA
B.常温常压下,3.0 g含甲醛的冰醋酸中含有的原子总数为0.4NA
C.标准状况下,2.24 L的CCl4中含有的C﹣Cl键数为0.4NA
D.将CO2通过Na2O2使其增重a克时,反应中转移的电子数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据相关报道,在日本生产的婴儿奶粉中检测到铯的人工放射性核素.下列说法正确的是( ) 
A.133Cs的核电荷数为133
B.133Cs+核外有54个电子
C.133Cs的质子数比137 Cs少4个
D.铯与水的反应比钠与水的反应缓慢
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com