
短周期金属元素甲~戊在元素周期表中的相对位置如右表所示.下列判断正确的是( )

|
| A. | 原子半径:丙<丁<戊 | B. | 氢氧化物碱性:丙>丁>戊 |
|
| C. | 金属性:甲>丙 | D. | 最外层电子数:甲>乙 |
考点:
位置结构性质的相互关系应用.
专题:
元素周期律与元素周期表专题.
分析:
根据元素所在周期表中的位置,结合元素周期律的递变规律比较原子半径、碱性、金属性等问题.
解答:
解:A、丙、丁、戊在周期表中同一周期,原子半径从左到右逐渐减小,则有丙>丁>戊,故A错误;
B、丙、丁、戊在周期表中同一周期,同一周期元素的金属性从左到右之间减弱,对应的最高价氧化物的水化物的碱性逐渐减弱,则有氢氧化物碱性:丙>丁>戊,故B正确;
C、甲、丙在同一主族,同主族元素从上到下元素的金属性逐渐增强,故甲<丙,故C错误;
D、甲、乙在同一周期,同一周期元素的原子序数逐渐增大,最外层电子数逐渐增多,则有甲<乙,故D错误.
故选B.
点评:
本题考查位置结构性质的相互关系及应用,题目难度不大,注意把握元素周期律的主要内容,把握比较元素及其化合物性质的方法.


 小天才课时作业系列答案
小天才课时作业系列答案 一课四练系列答案
一课四练系列答案 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案 新辅教导学系列答案
新辅教导学系列答案 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案科目:高中化学 来源: 题型:
利用芳香烃X和烯烃Y可以合成紫外线吸收剂BA D,其结构简式为:
D,其结构简式为:
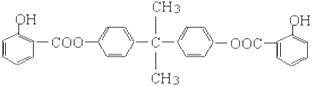
BAD的合成路线如下:
已知:G不能发生银镜反应,B遇FeCl3溶液显紫色,C到D的过程为引入羧基(—COOH)的反应。

试回答下列问题:
(1)写出结构简式:Y ,D 。
(2)上述属于取代反应的有 ( 填数字序号)。
(3)1molBAD最多可与含  molNaOH的溶液完全反应。
molNaOH的溶液完全反应。
(4)E有多种同分异构体,判断符合下列要求的同分异构体数目为 种。
①能发生银镜反应 ②遇FeCl3溶液显紫色 ③核磁共振氢谱图中有四个吸收峰
(5)写出反应②和④方程式 。
| |
查看答案和解析>>
科目:高中化学 来源: 题型:
短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如图所示.下列说法正确的是( )
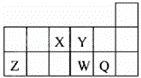
|
| A. | 元素X与元素Z的最高正化合价之和的数值等于8 |
|
| B. | 原子半径的大小顺序为:rX>rY>rZ>rW>rQ |
|
| C. | 离子Y2﹣和Z3+的核外电子数和电子层数都不相同 |
|
| D. | 元素W的最高价氧化物对应的水化物的酸性比Q的强 |
查看答案和解析>>
科目:高中化学 来源: 题型:
50mL 0.50mol•L﹣1的盐酸与50mL 0.55mol•L﹣1NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热,完成下列问题:
(1)从实验装置上看,图中尚缺少的一种玻璃用品是 .请指出装置中的另外错误是 .
(2)烧杯间填满碎纸条的作用是 .
(3)大烧杯上如不盖硬纸板,求得的中和热 (填“偏大”“偏小”“无影响”).
(4)实验中改用60mL 0.50 mol•L﹣1的盐酸跟60mL 0.55 mol•L﹣1NaOH溶液进行上述实验相比,所放出的热量 (填“相等”“不相等”),所求中和热 (填“相等”“不相等”).
(5)用相同浓度体积的氨水代替NaOH溶液进行上述实验,测得的中和热的数值会 ;用50mL 0.50mol•L﹣1NaOH溶液进行上述实验,测得的中和热的数值会 (均填“偏大”“偏小”“无影响”).

查看答案和解析>>
科目:高中化学 来源: 题型:
如图所示是Zn和Cu形成的原电池,某实验兴趣小组做完实验后,在读书卡上的记录如下,则卡片上的描述合理的是( )
| 2011.3.18,实验后的记录: ①Cu为负极,Zn为正极 ②Cu极上有气泡产生,发生还原反应 ③SO42﹣向Cu极移动 ④若有0.5mol电子流经导线,则可产生0.25mol气体 ⑤电子的流向是:Cu﹣→Zn ⑥正极反应式:Cu+2e﹣═Cu2+,发生氧化反应 |
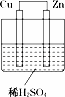
|
| A. | ①②③ | B. | ②④ | C. | ②③④ | D. | ③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
海水中有丰富的资源,多种多样的海洋动物和植物,海底有丰富的矿藏、石油、天然气等,此外,海水中还含有大量的电解质,它们电离产生Cl﹣、Br﹣(溴离子)、SO42﹣、Na+、Mg2+、Ca2+等,都是重要资源.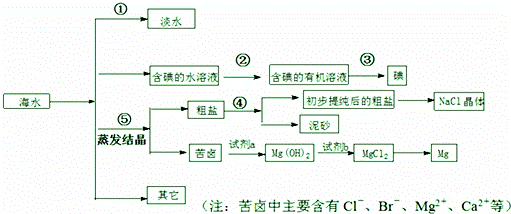
(1)写出步骤①、②、④分离提纯的方法:
① ② ④
(2)步骤②分离提纯过程中需要选用主要玻璃仪器的名称 .
(3)欲除去初步提纯后的粗盐中的MgCl2、CaCl2和Na2SO4,应向该粗食盐水中依次加入NaOH溶液、 溶液、 溶液,然后过滤;为尽可能除去杂质,每次加入的试剂应 量.向所得溶液中滴加 至无气泡产生,再经蒸发结晶得到食盐晶体.
(4)检验淡水中是否含有Cl﹣ 的操作现象及结论 .
(5)写出加入试剂a后,发生反应的离子方程式 .
(6)工业上用电解饱和食盐水的方法生产氯气、氢气和烧碱,请写出利用氯气和消石灰制取漂白粉的化学方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
对下列实验过程的评价,正确的是()
A. 某固体中加入稀盐酸,产生了无色气体,证明该固体中一定含有碳酸盐
B. 某溶液中先滴加稀盐酸酸化,再滴加几滴BaCl2溶液,生成白色沉淀,证明一定含有SO42﹣
C. 某无色溶液滴入紫色石蕊试液显红色,该溶液一定显碱性
D. 验证烧碱溶液中是否含有Cl﹣,先加稀硝酸除去OH﹣,再加入AgNO3溶液,有白色沉淀,证明含有Cl﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
在密闭容器中发生如下反应mA(g)+nB(g)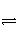
 pC(g),达到平衡后,保持温度不变,将气体体积缩小到原来的
pC(g),达到平衡后,保持温度不变,将气体体积缩小到原来的 ,当达到新平衡时,C的浓度为原来的1.9倍,下列说法正确的是( )
,当达到新平衡时,C的浓度为原来的1.9倍,下列说法正确的是( )
A.m+n>pB.平衡向逆反应方向移动
C.A的转化率提高D.C的体积分数增加
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com