
“禁止化学武器组织”获得2013年诺贝尔和平奖。Cl2是最早作为化学武器在战争中使用的有毒气体,但Cl2及其化合物在生活、生产中有广泛的用途,请回答下列与氯有关的问题:
(1)请画出氯离子结构示意图: 。
(2)漂白粉是灾后饮用水常用消毒剂,写出工业上制漂白粉的化学反应方程式: 。
(3)FeCl3可用作净水剂。室温时在FeCl3溶液中逐滴加入NaOH溶液,当pH=3时就开始产生沉淀,则原FeCl3溶液中c(Fe3+)大于 mol/L(已知:Ksp[Fe(OH)3=4.0×10-39])
(4)“84”消毒液的有效成分为NaClO,1mol Cl2 与含2mol NaOH溶液反应后,离子浓度由大到小的顺序为 。
(5)ClO2是高效水处理剂,用NaClO2与NCl3反应可以制得ClO2。已知在NCl3分子中成键原子共用电子对偏向于N原子,有关反应式为:
NaClO2 + NCl3 + H2O→ClO2↑+NH3↑+ NaCl + (未配平)。
①该反应中未知的生成物是 (填化学式)。
②该反应中被氧化的原子与被还原的原子的物质的量之比为 。
科目:高中化学 来源:2015-2016学年江西省高一上学期期中考试化学试卷(解析版) 题型:选择题
下列说法中正确的是
A.三氧化硫的水溶液能导电,所以三氧化硫是电解质
B.1 mol·L-1的硫酸钠溶液和1 mol·L-1的氢氧化钠溶液,分别做导电性实验,两种溶液的导电性不同
C.氢氧化铁胶体能导电,故氢氧化铁胶体是电解质
D.在相同温度下,饱和溶液一定比不饱和溶液的导电性强
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江苏省盐城市高二上学期期中考试化学试卷(解析版) 题型:选择题
下列物质液体混合,用分液漏斗能分离两组分的是
A.乙酸乙酯和乙醇 B.乙酸和水 C.苯和水 D.苯和溴
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖北省枣阳市高一上学期期中考试化学试卷(解析版) 题型:选择题
下列解释事实的离子方程式正确的是
A.铁和稀硝酸反应制得浅绿色溶液:Fe + 4H+ + NO3-  Fe3+ + NO↑+ 2H2O
Fe3+ + NO↑+ 2H2O
B.实验室盛碱液的瓶子不用玻璃塞:SiO2 + 2OH-  SiO32-+ H2O
SiO32-+ H2O
C.用稀盐酸和大理石反应制取CO2:CO32- + 2H+  CO2↑ + H2O
CO2↑ + H2O
D.向Ca(ClO)2溶液中通入过量CO2制取次氯酸: 2ClO- + H2O + CO2  2HClO + CO32-
2HClO + CO32-
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山西省高二上12月月考化学试卷(解析版) 题型:填空题
煤化工是以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业过程。
(1)将水蒸气通过红热的碳即可产生水煤气。反应为:
C(s) +H2O(g)  CO(g) +H2(g) △H= +131.3kJ·mol-1
CO(g) +H2(g) △H= +131.3kJ·mol-1
一定温度下,在一个容积固定的密闭容器中,发生上述反应,下列不能判断该反应达到化学平衡状态的是 (填字母)。
a.容器中的压强不变 b.1mol H-H 键断裂的同时断裂2molH-O键
c.v正(CO)= v逆(H2O) d.c(CO) =c(H2)
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2 L的恒容密闭容器中,进行反应
CO(g)+H2O(g) CO2(g)+ H2(g),得到如下三组数据:
CO2(g)+ H2(g),得到如下三组数据:
实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所 需时间/min | ||
H2O | CO | H2 | CO | |||
1 | 650 | 2 | 4 | 1.6 | 2.4 | 5 |
2 | 900 | 1 | 2 | 0.4 | 1.6 | 3 |
3 | 900 | a | b | c | d | t |
①该反应的逆反应为 (填“吸”或“放’’)热反应
②若实验3要达到与实验2中各物质的质量分数分别相等,且t<3min,则a、b应满足的关系是
(用含a、b的数学式表示)。
(3)目前工业上有一种方法是用CO2来生产甲醇。一定条件下发生反应:
CO2(g)+ 3H2(g) CH3OH(g)+H2O(g),右图表示该反应进行过程中能量(单位为kJ·mol)的变化。
CH3OH(g)+H2O(g),右图表示该反应进行过程中能量(单位为kJ·mol)的变化。
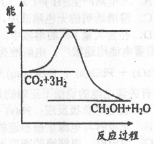
①在体积为1 L的恒容密闭容器中,充入l molCO2和3molH2,下列措施中能使c(CH3OH)增大的是 (填字母)
a.升高温度 b.充入He(g),使体系压强增大
c.将H2O(g)从体系中分离出来 d.再充入l mol CO2和3 molH2
②当反应达到平衡时不断改变条件(但不改变各组分物质的量和状态)反应速率随时间的变化如图:其中表示平衡混合物中CH3OH含量最高的一段时间是 ;如t0~t1平衡常数为K1,t2~t3平衡常数为K2,则K1 K2(填“大于”、“等于”或“小于”)。

查看答案和解析>>
科目:高中化学 来源:2016届福建省高三上学期半期考试化学试卷(解析版) 题型:选择题
辨析以下的说法:①l6O与 l8O的转化可以通过化学反应实现;②灼烧钠的化合物时火焰呈黄色,那是发生了化学反应;③碱性氧化物一定是金属氧化物;④只由一种元素组成的物质一定是纯净物;⑤石墨与金刚石的转化是化学变化。上述说法中正确的是
A.③⑤ B.②④ C.④⑤ D.①③
查看答案和解析>>
科目:高中化学 来源:2016届黑龙江省高三上学期第二次检测化学试卷(解析版) 题型:选择题
已知:CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H=-49.0kJ·mol-1一定条件下,向体积为1L的恒容密闭容器中充入lmolCO2和3mo1H2,测得CO2和CH3OH(g)的浓度随时间变化曲线如图所示。下列叙述中正确的是
CH3OH(g)+H2O(g) △H=-49.0kJ·mol-1一定条件下,向体积为1L的恒容密闭容器中充入lmolCO2和3mo1H2,测得CO2和CH3OH(g)的浓度随时间变化曲线如图所示。下列叙述中正确的是
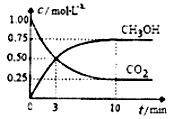
A.3min时,用CO2的浓度表示的正反应速率等于用CH3OH的浓度表示的逆反应速率
B.从反应开始到平衡,H2的平均反应速率v(H2)=0.225 mol·L-1·min-1
C.13min时,向容器中充入 2mol氦气,该反应的化学反应速率增大
D.13min时,向容器中充入 2mol CO2,该反应化学平衡常数增大
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河北省高二12月月考化学试卷(解析版) 题型:选择题
一定温度下,反应N2(g)+3H2(g) 2NH3(g)达到化学平衡状态的标志是
2NH3(g)达到化学平衡状态的标志是
A.N2、H2和NH3的物质的量分数不再改变
B.c(N2)∶c(H2)∶c(NH3)=1∶3∶2
C.N2与H2的物质的量之和是NH3的物质的量的2倍
D.单位时间里每增加1 mol N2,同时增加3 mol H2
查看答案和解析>>
科目:高中化学 来源:2016届江苏省高三上期中测试化学试卷(解析版) 题型:填空题
镍(28Ni)在金属羰基化合物[金属元素和一氧化碳(CO)中性分子形成的一类配合物]、金属储氢材料[能可逆的多次吸收、储存和释放氢气(H2)的合金]等领域用途广泛。
(1)Ni原子基态核外电子排布式为_________________。
(2)Ni(CO)4中镍的化合价为___________,写出与CO互为等电子体的中性分子、带一个单位正电荷的阳离子、带一个单位负电荷的阴离子各一个:________、___________、_________。
(3)一种储氢合金由镍与镧(La)组成,其晶胞结构示意图如图1所示.则该晶体的化学式为 _________。

(4)下列反应常用来检验Ni2+,请写出另一产物的化学式。
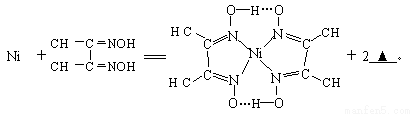
与Ni2+配位的N原子有______ 个,该配合物中存在的化学键有__________(填序号)。
A.共价键 B 离子键 C 配位键 D 金属键 E 氢键
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com