
工业上制备纯硅反应的热化学方程式如下:SiCl4(g)+2H2(g)⇌Si(g)+4HCl(g);△H=+Q kJ•mol﹣1(Q>0),某温度、压强下,将一定量反应物通入密闭容器进行以上反应,下列叙述正确的是( )
|
| A. | 反应过程中,若增大压强能提高SiCl4的转化率 |
|
| B. | 若反应开始时SiCl4为1mol,则达平衡时,吸收热量为Q kJ |
|
| C. | 反应至4min时,若HCl浓度为0.24 mol/L,则H2的反应速率为0.03 mol/(L•min) |
|
| D. | 当反应吸收热量为0.025Q kJ时,生成的HCl通入100mL 1mol•L﹣1的NaOH溶液恰好反应 |
考点:
化学平衡的影响因素;有关反应热的计算;化学平衡的计算.
专题:
化学反应中的能量变化;化学平衡专题.
分析:
A.增大平衡向气体体积减小的方向移动,据此判断;
B.该反应为可逆反应,1molSiCl4不能完全转化,结合热化学方程式判断;
C.根据v=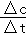 计算v(HCl),利用速率之比等于化学计量数之比计算判断;
计算v(HCl),利用速率之比等于化学计量数之比计算判断;
D.根据反应吸收的热量计算生成的HCl的物质的量,据此判断.
解答:
解:A.从方程式可以看出,反应物气体的计量数之和小于生成物气体的计量数之和,则增大压强,平衡向逆反应方向移动,SiCl4的转化率减小,故A错误;
B.该反应为可逆反应,1molSiCl4不能完全转化,达平衡时,吸收热量小于QkJ,故B错误;
C.反应至4min时,若HCl浓度为0.12mol/L,则v(HCl)=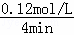 =0.03mol/(L•min),根据反应速率之比等于化学计量数之比,则v(H2)=
=0.03mol/(L•min),根据反应速率之比等于化学计量数之比,则v(H2)=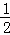 ×v(HCl)=
×v(HCl)=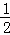 ×0.03mol/(L•min)=0.015mol/(L•min),故C错误;
×0.03mol/(L•min)=0.015mol/(L•min),故C错误;
D.由方程式可知,当反应吸收热量为0.025QkJ时,生成HCl的物质的量为: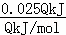 =0.1mol,100mL1mol/L的NaOH的物质的量为0.1L×1mol/L=0.1mol,二者物质的量相等,恰好反应,故D正确;
=0.1mol,100mL1mol/L的NaOH的物质的量为0.1L×1mol/L=0.1mol,二者物质的量相等,恰好反应,故D正确;
故选D.
点评:
本题考查较为综合,涉及反应热的计算、化学反应速率、化学平衡等问题,题目难度中等,注意反应的可逆性.


科目:高中化学 来源: 题型:
某元素位于第三周期第ⅥA族.下列叙述不正确的是( )
|
| A. | 该元素是非金属元素 |
|
| B. | 该元素原子的核电荷数为16 |
|
| C. | 该元素原子核外有3个电子层 |
|
| D. | 该元素原子容易失去最外层电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
白磷与氧可发生如下反应:P4+5O2═P4O10.已知断裂下列化学键需要吸收的能量分别为:P﹣P:a kJ•mol﹣1、P﹣O:b kJ•mol﹣1、P=O:c kJ•mol﹣1、O=O:d kJ•mol﹣1.根据图示的分子结构和有关数据估算该反应的△H,其中正确的是( )
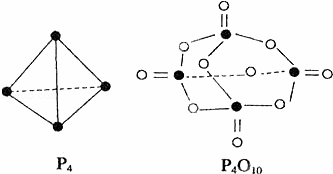
|
| A. | (6a+5d﹣4c﹣12b)kJ•mol﹣1 | B. | (4c+12b﹣6a﹣5d)kJ•mol﹣1 |
|
| C. | (4c+12b﹣4a﹣5d)kJ•mol﹣1 | D. | (4a+5d﹣4c﹣12b)kJ•mol﹣1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
一定温度下,固定体积的容器中充入1mol SO2和1mol O2,再加入少量的NO,在体系中发生①2NO+O2=2NO2;②SO2+NO2=SO3+NO,下列说法中不正确的是( )
|
| A. | 体系中的总反应是:2SO2+O2⇌2SO3 |
|
| B. | 在反应过程中NO是催化剂 |
|
| C. | NO参与反应历程,降低反应活化能,加快反应速率 |
|
| D. | NO的引入可以增加SO2的平衡转化率 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组试剂(括号内的是滴加试剂)做溶液导电性实验的过程中,可以观察到灯泡由亮变暗直至熄灭,然后又逐渐变亮的是( )
|
| A. | BaCl2溶液(稀硫酸) | B. | 氨水(醋酸溶液) |
|
| C. | Ba(OH)2溶液[Ba(HCO3)2溶液] | D. | Ba(OH)2溶液(NaHSO4溶液) |
查看答案和解析>>
科目:高中化学 来源: 题型:
化学反应原理在生产、生活、国防上有重要的应用.例如:
联氨(N2H4)及其衍生物是一类重要的火箭燃料.N2H4与N2O4反应能放出大量的热.
①已知:2NO2(g)⇌N2O4(g)△H=﹣57.20kJ•mol﹣1.
一定温度下,在密闭容器中反应2NO2(g)⇌N2O4(g)达到平衡.
其他条件不变时,下列措施能提高NO2转化率的是 (填字母).
A.减小NO2的浓度 B.降低温度 C.增加NO2的浓度 D.升高温度
②下表为反应2NO2(g)⇌N2O4(g)在17℃、1.01×105Pa下的部分实验数据:
| 时间/s | 0 | 80 | 160 | 240 | 320 |
| c(NO2)/mol•L﹣1 | 0.0540 | 0.0420 | 0.0340 | 0.0300 | 0.0300 |
| c(N2O4)/mol•L﹣1 | 0 | 0.0060 | 0.0100 | 0.0120 | 0.0120 |
该温度下反应N2O4(g)⇌2NO2(g)的平衡常数K的值为 .
(写出计算过程)
③25℃时,1.00gN2H4(l)与足量N2O4(l)完全反应生成N2(g)和H2O(l),放出19.14kJ的热量.
则该反应的热化学方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
向一定量的FeO、Fe、Fe2O3的混合物中加入100ml1mol/L的盐酸,恰好使混合物完全溶解,放出224ml标况下的气体,在所得溶液中滴入硫氰化钾溶液无血红色出现(即无3价铁).若用足量CO在高温下还原同质量的此混合物,能得到铁的质量是()
A. 11.2g B. 5.6g C. 2.8g D. 无法计算
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验操作可以达到实验目的是( )
| 实验目的 | 实验操作 | |
| A. | 验证乙炔能被酸性高锰酸钾溶液氧化 | 将电石与饱和食盐水反应生成的气体通入酸性高锰酸钾溶液,观察溶液是否褪色 |
| B. | 检验淀粉水解产物的还原性 | 取少量淀粉溶液,与稀硫酸共热后再加入银氨溶液,水浴加热,观察是否出现银镜 |
| C. | 除去乙酸乙酯中混有的少量乙酸 | 加入足量饱和Na2CO3溶液,振荡,静置,分液,取出上层液体 |
| D. | 检验溴乙烷中的溴元素 | 取少量溴乙烷,与氢氧化钠溶液共热后加入硝酸银溶液,观察是否出现白色沉淀 |
|
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:
在一个固定容积为2 L的密闭容器中2 mol A和1 mol B发生反应2A(g)+B(g)3C(g)+D(g),达到平衡时,C的浓度为0.3 mol/L,则A的浓度和B的浓度分别是( )
A.0.2 mol·L-1 0.1 mol·L-1
B.0.4 mol·L-1 0.2 mol·L-1
C.0.8 mol·L-1 0.4 mol·L-1
D.0.6 mol·L-1 0.3 mol·L-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com