��1����2CH
3OH��l��+3O
2��g��=2CO
2��g��+4H
2O��g����H=
_1275.6kJ?mol
-1��2CO��g��+O
2��g��=2CO
2��g����H=
_556.0kJ?mol
-1��H
2O��l��=H
2O��g����H=+44.0kJ?mol
-1�����Ȼ�ѧ����ʽ��˹���ɢ�-��-�ۡ�4�õ�CH
3OH��l��+O
2��g��=CO ��g��+2H
2O��l����H=
_447.8 kJ?mol
-1��
�ʴ�Ϊ��CH
3OH��l��+O
2��g��=CO ��g��+2H
2O��l����H=
_447.8 kJ?mol
-1��
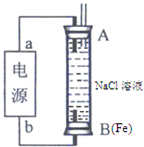
��2���״�ȼ�ϵ��Ϊ��Դ��ⷨ��ȡFe��OH��
2��ʵ��װ�ã�ͨ�����Һ�в��������İ�ɫ�������ҽϳ�ʱ�䲻��ɫ��˵��������������B�缫�������ɣ����Ե缫AΪ���ص�������BΪ���ص���������ԴaΪ�������缫��ӦΪ�����õ����ӵõ����ӷ�����ԭ��Ӧ��O
2+4e
-+2H
2O=4OH
-������������A�缫������Ŀ������������ʧ���������������ӣ����������ɵ����������ӷ�Ӧ���ɰ�ɫ����������������bΪ���������ӵ缫B�缫��ӦΪ��2H
++2 e
-=H
2����
�ʴ�Ϊ������O
2+4e
-+2H
2O=4OH
-��Fe��2H
++2 e
-=H
2������2H
2O+2e
-=H
2+2OH
-����
��3����CO��g��+H
2O��g��?CO
2��g��+H
2��g������Ӧǰ������������䣬��ʼ������һ�룬ƽ�ⲻ����Ӧƽ��ʱ������̼Ũ��Ϊ0.8mol/L����������ͼ�����ݿ�֪�¶�����ƽ��״̬��������У�˵������Ӧ�Ƿ��ȷ�Ӧ��
�ʴ�Ϊ���ţ�
��CO��g��+H
2O��g��?CO
2��g��+H
2��g��
��ʼ����mol��2 4 0 0
�仯����mol��1.6 1.6 1.6 1.6
ƽ������mol��0.4 2.4 1.6 1.6
ʵ��1�У���v��H
2����ʾ��ƽ����Ӧ����=
=0.16mol/��L?min����
�ʴ�Ϊ��0.16mol/��L?min����
��900��Cƽ��״̬��ƽ�ⳣ������Ϊ
CO��g��+H
2O��g��?CO
2��g��+H
2��g��
��ʼ����mol�� 1 2 0 0
�仯����mol�� 0.4 0.4 0.4 0.4
ƽ������mol��0.6 1.6 0.4 0.4
K=
=
=0.17
��CO��g����H
2O��g����CO
2��g�� �� H
2��g�������ʵ����ֱ���0.8mol��1.0mol��0.6mol��0.8mol�ֱ���������
Qc=
=
=0.6��K
��Ӧ������У�v��������v���棩
�ʴ�Ϊ������
��ʵ��3��ʵ��2��ȣ��ﵽ��ͬ��ƽ��״̬����Ӧǰ������������䣬��Ӧ��������˵������ѹǿ�����������ϣ��ı������������ʹ���˴������Ӵ���ѹǿ��
�ʴ�Ϊ��ʹ���˴������Ӵ���ѹǿ��



 ����һ������ܼƻ�ϵ�д�
����һ������ܼƻ�ϵ�д�

 2009��12��7��һ18���ڵ������籾�����ٿ������Ϲ�������飬��δ��Ӧ������仯��ȫ���ж�ǩ���µ�Э�飮����ν��ʹ�����CO2�ĺ�������Ч�ؿ�������CO2��������ȫ������ձ����ӣ�Ϊ��С������CO2�Ի�����Ӱ�죬һ����������������������ŷ�������һ�����ѧ�Ҽ�ǿ�˶�CO2�������õ��о���
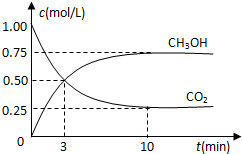
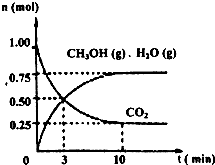
2009��12��7��һ18���ڵ������籾�����ٿ������Ϲ�������飬��δ��Ӧ������仯��ȫ���ж�ǩ���µ�Э�飮����ν��ʹ�����CO2�ĺ�������Ч�ؿ�������CO2��������ȫ������ձ����ӣ�Ϊ��С������CO2�Ի�����Ӱ�죬һ����������������������ŷ�������һ�����ѧ�Ҽ�ǿ�˶�CO2�������õ��о���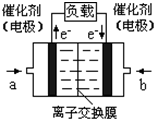 ��ͼ����a��ͨ�����
��ͼ����a��ͨ�����
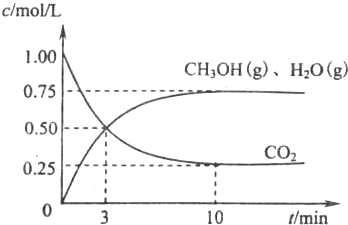
 CH3OH��g��+H2O��g��
CH3OH��g��+H2O��g�� CH3OH��g��+H2O��g��
CH3OH��g��+H2O��g��