
| A、在25℃时,任何水溶液中KW=1×10-14 |
| B、在NaHSO4溶液中,c(H+)=c(OH-)+c(SO42-) |
| C、在PH=2的盐酸酸化的FeCl3溶液,稀释至10倍,则溶液PH=3 |
| D、0.1mol?L-1醋酸溶液中加入冰醋酸,平衡正向移动,醋酸的电离程度增大 |


科目:高中化学 来源: 题型:
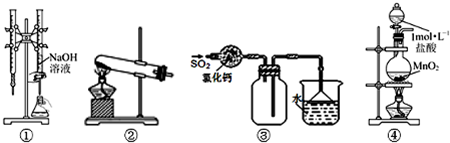
| A、装置①可用于已知浓度的氢氧化钠溶液测定未知浓度盐酸的实验 |
| B、装置②可用于氯化铵固体和氢氧化钙固体反应制取少量氨气 |
| C、装置③可用于收集SO2,并吸收多余的SO2 |
| D、装置④可用于制取少量Cl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
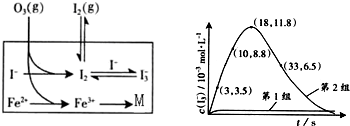
A、在溶液中存在化学平衡I2(aq)+I-(aq)?I3-(aq),其平衡常数表达式为
| ||||
| B、第2组实验进行18s后,由于I2(g)不断生成导致I3-浓度下降 | ||||
| C、3-18s内第2组实验中生成I3-的平均反应速率约为0.55mol/(L?s) | ||||
| D、Fe2+可作为O3氧化I-的催化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、均存在电离平衡和水解平衡 |
| B、存在的粒子种类不相同 |
| C、均存在c(Na+)+c(H+)=c(CO32-)+c(OH-)+c(HCO3-) |
| D、均存在c(Na+)>c(HCO3-)>c(CO32-)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、石灰石与盐酸反应:CO32-+2H+═CO2↑+H2O |
| B、Cl2通入烧碱溶液中:Cl2+2OH-═Cl-+ClO-+H2O |
| C、氢氧化铜和硫酸反应:OH-+H+═H2O |
| D、将金属铝(无氧化膜)加入氢氧化钠溶液中:Al+2OH-═AlO2-+H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、稀硫酸中:K+、Mg2+、AlO2-、S2O32- | ||
| B、NaHS溶液中:SO42-、K+、Cl-、Cu2+ | ||
C、
| ||
| D、通入大量CO2的溶液中:Na+、ClO-、CH3COO-、HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com