
【题目】实验室制备1,2二溴乙烷的反应原理如下:CH3CH2OH![]() CH2=CH2+H2O,CH2=CH2+Br2―→BrCH2CH2Br。用少量的溴和足量的乙醇制备1,2二溴乙烷的装置如下图所示:
CH2=CH2+H2O,CH2=CH2+Br2―→BrCH2CH2Br。用少量的溴和足量的乙醇制备1,2二溴乙烷的装置如下图所示:

有关数据列表如下:
乙醇 | 1,2二溴乙烷 | 乙醚 | |
状态 | 无色液体 | 无色液体 | 无色液体 |
密度/g·cm-3 | 0.79 | 2.2 | 0.71 |
沸点/℃ | 78.5 | 132 | 34.6 |
熔点/℃ | -130 | 9 | -116 |
回答下列问题:
(1)在装置c中应加入________(选填序号),其目的是吸收反应中可能生成的酸性气体。
①水 ②浓硫酸 ③氢氧化钠溶液 ④饱和碳酸氢钠溶液
(2)装置b的作用是___________。
(3)将1,2-二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在水的________(填“上”或“下”)层。
(4)若产物中有少量未反应的Br2,最好用________(填正确选项前的序号)洗涤除去。
①水 ②氢氧化钠溶液 ③碘化钠溶液 ④乙醇
(5)反应过程中需用冷水冷却(装置e),但不用冰水进行过度冷却,原因是___________________________。
(6)以1,2二溴乙烷为原料,制备聚氯乙烯,为了提高原料利用率,有同学设计了如下流程:1,2二溴乙烷通过反应①制得A,A通过反应②制得氯乙烯,由氯乙烯制得聚氯乙烯。
①________________(填反应类型) ②________________(填反应类型)
A________________(填该物质的电子式)
写出第一步反应①的化学方程式_______________________________。
【答案】 ③ 防倒吸 下 ② 1,2二溴乙烷的凝固点较低(9 ℃),过度冷却会使其凝固而使气路堵塞 消去反应 加成反应 H:CC:H 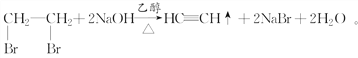
【解析】a中乙醇在浓硫酸的存在下在170℃脱水生成乙烯,由于浓硫酸的强氧化性、脱水性导致生成的乙烯气体中含有杂质二氧化硫、二氧化碳、水蒸气等杂质;b为安全瓶,可以防止倒吸;装置c中可以用氢氧化钠溶液吸收乙烯中杂质气体;d中乙烯与溴反应,装置e冷却可避免溴的大量挥发;f是尾气吸收装置。
(1)乙烯气体中含有杂质二氧化硫、二氧化碳、水蒸气等酸性杂质,用碱性试剂吸收,饱和碳酸氢钠不能吸收二氧化碳,故选用氢氧化钠吸收;故答案为:③;
(2)b为安全瓶,可以防止倒吸,故答案为:防倒吸;
(3)1,2-二溴乙烷密度比水大,所以加水,振荡后静置,产物应在下层,分离得到产品,故答案为:下;
(4)Br2与氢氧化钠反应,1,2-二溴乙烷不溶于水溶液,故选用氢氧化钠溶液吸收少量未反应的Br2;故答案为:②;
(5)反应过程中需用冷水冷却(装置e),但不用冰水进行过度冷却,因为1,2二溴乙烷的凝固点较低(9 ℃),过度冷却会使其凝固而使气路堵塞,故答案为:1,2二溴乙烷的凝固点较低(9 ℃),过度冷却会使其凝固而使气路堵塞;
(6)以1,2-二溴乙烷为原料,制备聚氯乙烯,可以先用1,2-二溴乙烷通过消去反应制得乙炔,然后通过乙炔与氯化氢的加成反应制得氯乙烯,最后由氯乙烯通过加聚反应制得聚氯乙烯,反应①为1,2-二溴乙烷通过消去反应制得乙炔,反应为:![]() ,②为乙炔与氯化氢的加成反应制得氯乙烯,
,②为乙炔与氯化氢的加成反应制得氯乙烯,
故答案为:消去反应;加成反应;H:CC:H ;![]() 。
。


科目:高中化学 来源: 题型:
【题目】CuSO4、Fe2(SO4)3、H2SO4的混合溶液100 mL,已知溶液中阳离子的浓度相同(不考虑水解),且SO![]() 的物质的量浓度为3 mol·L-1,则此溶液最多溶解铁粉的质量为( )信息:Fe2(SO4)3+Fe=3FeSO4
的物质的量浓度为3 mol·L-1,则此溶液最多溶解铁粉的质量为( )信息:Fe2(SO4)3+Fe=3FeSO4
A. 5.6 g B. 11.2 g C. 22.4 g D. 33.6 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质分离或提纯方法的叙述中,不正确的是( )
A.用酒精萃取碘水中的碘
B.用蒸馏的方法将自来水制成蒸馏水
C.用溶解、过滤的方法分离硝酸钾和沙子
D.用加热的方法分离氯化钠和氯化铵固体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋植物如海带、海藻中含有大量的碘元素,碘元素以碘离子的形式存在。实验室里从海藻中提取碘的流程如图:
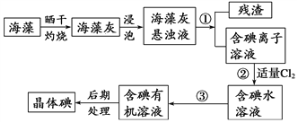
(1)提取碘的过程中有关的实验操作名称:①_______________,③_______________。
(2)提取碘的过程中,不能选择乙醇作有机萃取剂的原因是_____________________。
(3)第③步时使用的主要玻璃仪器有_______________________。
(4)小组用CCl4萃取碘水中的碘,在图中,下层液体呈______色;他们打开仪器下端的活塞,却未见液体流下,原因可能是_________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】掌握仪器名称、组装及使用方法是中学化学实验的基础,下图为两套实验装置。
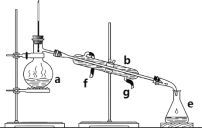
(1)写出下列仪器的名称:a.____________,b.___________,c.__________。
(2)仪器a~e中,使用前必须检查是否漏水的有___________。(填序号)
(3)若利用装置分离四氯化碳和酒精的混合物,还缺少的仪器是__________,将仪器补充完整后进行实验,温度计水银球的位置在_______处。冷凝水由____口流出(填f或g)。
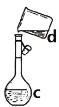
(4)现需配制0.1mol/LNaOH溶液450mL,装置是某同学转移溶液的示意图。
①图中的错误是_____________________________。
②根据计算得知,所需NaOH的质量为_______。
③配制时,其正确的操作顺序是(字母表示,每个字母只能用一次)_____________。
A.用30mL水洗涤烧杯2~3次,洗涤液均注入容量瓶
B.准确称取计算量的氢氧化钠固体于烧杯中,再加入少量水(约30mL),用玻璃棒慢慢搅动,使其充分溶解
C.将溶解的氢氧化钠溶液沿玻璃棒注入500mL的容量瓶中
D.将容量瓶盖紧,振荡,摇匀
E.改用胶头滴管加水,使溶液凹面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻度2~3cm处
(5)若出现如下情况,对所配溶液浓度将有何影响(填“偏高”、“偏低”或“无影响”)。若没有进行A操作___________;容量瓶用蒸馏洗涤后残留有少量的水_____________;若定容时俯视刻度线__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,关于等体积、等pH的稀盐酸和稀醋酸溶液,下列说法正确的是
A. 两溶液中c(OH-):盐酸<醋酸
B. 醋酸溶液中c(H+)=c(CH3COO-)
C. 中和同浓度NaOH溶液的能力:盐酸<醋酸
D. 分别用水稀释相同倍数后,两溶液pH仍相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】回答下列问题
(1)3.01×1023个HNO3的物质的量是_________
(2)HNO3的摩尔质量是____________________;94.5g HNO3的物质的量是_______________
(3)1.5NA个H2O中,H原子的物质的量是__________
(4)6.02×1023个H2SO4分子中H+的质量为___________
(5)9g NH4+中的原子数目是______________;电子数目是________________
(6)含a g Cu2+的CuCl2中Cl- 的个数___________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取不同质量由 Ba(OH)2和 BaCO3组成的均匀混合样品,先加适量的水溶解,然后加入100mL某浓度稀盐酸,所得CO2气 体的体积(己换算为标准状况)与加入样品的质量关系如图所示(不考虑CO2的溶解、反应及碳酸氢盐的生成)。请计算:
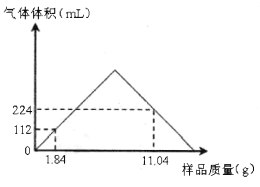
(1)混合物中Ba(OH)2和 BaCO3物质的量之比为________。
(2)稀盐酸物质的量浓度为________mo1/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如图所示装置进行实验,实验现象与对应的结论均正确的是
装置 | ① | ② | 实验现象 | 结论 | |
| A | 铜丝 | 稀硝酸 | ②出现红棕色气体 | 硝酸与铜生成了NO2③中需要碱溶液吸收尾气 |
B | 底端灼热的碳棒 | 浓硝酸 | ②中出现红棕色气体 | 产生气体一定是混合气体 | |
C | 铜丝 | Fe2(SO4)3溶液 | ②中溶液黄色变浅 | Cu与Fe2(SO4)3溶液发生置换反应 | |
D | 铁丝 | 浓硫酸 | 无明显现象 | 铁与浓硫酸不反应 |
A. A B. B C. C D. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com