
| A. | Q2=$\frac{1}{2}$ Q1=98.5 | B. | Q2=$\frac{1}{2}$ Q1<98.5 | C. | Q2<$\frac{1}{2}$ Q1<98.5 | D. | $\frac{1}{2}$Q1<Q2<98.5 |
分析 2SO2(g)+O2(g)?2SO3(g)△H=-167kJ/mol,含义为2mol二氧化硫与1mol氧气完全反应生成2mol三氧化硫放出热量167.5KJ,同温下,往相同体积的密闭容器甲、乙中分别充入2molSO2、1molO2和1molSO3、1molSO2、0.5mol,B与A相比较相当于加入生成物,且可逆反应不能进行到底,所以放出的热量小于按照方程式系数计算的理论热量,据此解答.
解答 解:2SO2(g)+O2(g)?2SO3(g)△H=-167kJ/mol,含义为2mol二氧化硫与1mol氧气完全反应生成2mol三氧化硫放出热量167.5KJ,则同温下,往相同体积的密闭容器甲充入2molSO2、1molO2,因为反应可逆,所以生成的三氧化硫的物质的量小于2mol,放出的热量小于Q1<167.5KJ;
通入1molSO2,0.5mol O2,如果转化率与加入2mol SO2和1molO2相同,则放热为0.5Q1kJ,
但是此时体系压强比加入2mol SO2和1molO2要小,所以平衡会向左移动,实际放出的热量<0.5Q1;
在1molSO2,0.5mol O2 的基础上再加1mol SO3,则平衡逆移,要吸收热量,所以通入1molSO2,
0.5mol O2 和1mol SO3时实际放出的热量Q2<0.5Q1;
所以放出热量:Q2<$\frac{1}{2}$ Q1<98.5;
故选:C.
点评 本题考查反应热的计算,明确热化学方程式的含义,熟悉可逆反应的特点是解题关键,题目难度中等.


 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:选择题
| A. | 5L | B. | 5.5L | C. | 6L | D. | 6.5L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
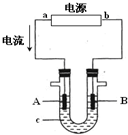 电解原理在化学工业中有广泛应用.图表示一个电解池,装有电解液c;A、B是两块电极板,通过导线与直流电源相连.请回答以下问题:
电解原理在化学工业中有广泛应用.图表示一个电解池,装有电解液c;A、B是两块电极板,通过导线与直流电源相连.请回答以下问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 滴定终点读数时,仰视滴定管的刻度,其它操作均正确 | |
| B. | 盛装未知液的滴定管用蒸馏水洗过,未用待测液润洗 | |
| C. | 滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液 | |
| D. | 未用标准液润洗碱式滴定管 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 )是其中的一种,它可以从茉莉花中提取,也可以用甲苯和乙醇为原料进行人工合成.一种合成路线如下:
)是其中的一种,它可以从茉莉花中提取,也可以用甲苯和乙醇为原料进行人工合成.一种合成路线如下: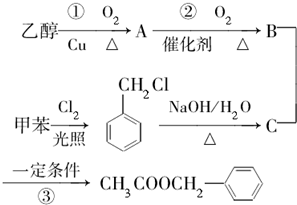
 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 弱电解质 | HCOOH | HCN | H2CO3 | NH3•H2O |
| 电离平衡常数 (25℃) | Ka=1.8×10-4 | Ka=4.9×10-10 | Ka1=4.3×10-7 Ka2=5.6×10-11 | Kb=1.8×10-5 |
| A. | 25℃时,若将pH=3的盐酸与pH=11的氨水混合后溶液显中性,则二者消耗的体积是:V(盐酸)>V(氨水) | |
| B. | 0.1mol/L的HCOONH4溶液中:c(HCOO-)>c(NH4+)>c(H+)>c(OH-) | |
| C. | 结合H+的能力:CO32->HCO3->CN->HCOO- | |
| D. | 0.1mol/L的NaHCO3溶液中:c(H2CO3)+c(H+)=c(OH-)+c(CO32-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3-CH2-NO2和H2N-CH2-COOH互为同分异构体 | |
| B. | O2和O3互为同素异形体 | |
| C. | H、D、T互为同位素 | |
| D. | 干冰和冰为同一种物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 46 g N2O4和NO2的混合物含原子总个数为3 NA | |
| B. | 钠在空气中燃烧可生成多种氧化物,则23g钠充分燃烧时转移电子数为1NA | |
| C. | 1 L 0.1 mol/L的KHCO3溶液中HCO3-和CO32-离子数之和为0.1NA | |
| D. | 60 g Si02中含Si-O键的个数为4 NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com