
| A. | 至少含有4种离子 | |
| B. | 取少量原溶液先加入盐酸,后加入BaCl2溶液,肯定会产生白色沉淀 | |
| C. | 若原溶液中加入硝酸酸化的硝酸银溶液产生白色沉淀,则可推断溶液中含有K+ | |
| D. | 溶液中可能含有Fe3+、NH4+、SO42-、Cl-、NO3- |
分析 ①取少量溶液加入足量的NaOH浓溶液,最终得到红褐色沉淀,则说明溶液中有Fe2+或Fe3+或两者均有,并伴有气泡产生,则说明含NH4+,过滤后的滤液中逐滴滴加稀硫酸至过量,过程中无沉淀产生,则溶液中无A13+、AlO2-;
②另取少量原溶液,加入稀硫酸溶液,有气体产生,并在空气中变为红色,则溶液中含Fe2+和NO3-,然后根据离子浓度均为0.1mol/L,溶液要保持电中性来分析.
解答 解:①取少量溶液加入足量的NaOH浓溶液,最终得到红褐色沉淀,则说明溶液中有Fe2+或Fe3+或两者均有,而溶液中存在Fe2+或Fe3+,则不能存在AlO2-、CO32-、SiO32-;
并伴有气泡产生,则说明含NH4+;过滤后的滤液中逐滴滴加稀硫酸至过量,过程中无沉淀产生,则说明溶液中无A13+、AlO2-;
②另取少量原溶液,加入稀硫酸溶液,有气体产生,并在空气中变为红色,则溶液中含Fe2+和NO3-.
故溶液中一定含NH4+、Fe2+、NO3-,一定无A13+、AlO2-、CO32-、SiO32-,由于离子浓度均为0.1mol/L,溶液要保持电中性,故溶液中一定要含SO42-,一定不含Fe3+,而K+和Cl-的存在不能确定,但两者只要一者存在,由于溶液要保持电中性,另一种则一定存在.
A、溶液中一定含NH4+、Fe2+、NO3-、SO42-,故A正确;
B、由于溶液中含SO42-,故BaCl2溶液,肯定会产生白色沉淀,故B正确;
C、若原溶液中加入硝酸酸化的硝酸银溶液产生白色沉淀,则溶液中含Cl-,由于溶液要保持电中性,则K+一定存在,故C正确;
D、由于溶液要保持电中性,故溶液中一定不含Fe3+,故D错误.
故选D.
点评 本题考查了离子的检验,根据题干提供的信息来分析存在的离子,并利用离子之间的互斥性来判断,同时应注意的是利用溶液的电中性来分析.


科目:高中化学 来源: 题型:选择题
| A. | 37.6% | B. | 36.8% | C. | 25.6% | D. | 51.2% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
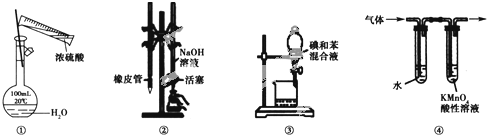
| A. | 图①所示装置进行浓硫酸稀释配制稀硫酸的实验 | |
| B. | 图②所示装置进行用已知浓度为NaOH溶液测定盐酸浓度的实验 | |
| C. | 图③所示装置进行用苯萃取碘水中碘的实验,并把碘的苯溶液从漏斗下口倒出 | |
| D. | 图④所示装置可检验溴乙烷发生消去反应得到的气体中含有乙烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ksp只与难溶电解质的性质和温度有关,而与溶液中的离子浓度无关 | |
| B. | 将饱和Na2SO4溶液加入到饱和石灰水中,有白色沉淀产生,说明Ksp[Ca(OH)2]大于Ksp[CaSO4] | |
| C. | 已知25℃时,Ksp[Fe(OH)3]=4.0×10-38,该温度下反应Fe(OH)3+3H+?Fe3++3H2O的平衡常数K=4.0×104 | |
| D. | 已知25℃时,Ksp[Mg(OH)2]=1.8×10-11,在MgCl2溶液中加入氨水调混合液的pH=11,产生沉淀,则此时溶液中的c(Mg2+)=1.8×10-5mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 按系统命名法,有机物 可命名为3,7-二甲基-4-乙基辛烷 可命名为3,7-二甲基-4-乙基辛烷 | |
| B. | 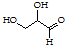 该有机物属于单糖,在一定条件下能发生取代、消去、加成、氧化、还原反应 该有机物属于单糖,在一定条件下能发生取代、消去、加成、氧化、还原反应 | |
| C. | 等质量的甲烷、乙烯、1,3-丁二烯分别充分燃烧,所耗用氧气的量依次增加 | |
| D. | 结构为…-CH=CH-CH=CH-CH=CH-CH=CH-…的高分子的单体是1,3-丁二烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol ${\;}_{8}^{16}$OD- 离子含有的质子、中子数均为1.0NA | |
| B. | 含有4.6 g钠元素的过氧化钠和氧化钠的混合物中,所含离子总数为0.3NA | |
| C. | 3.6 g石墨中,含有共价键数为0.3NA | |
| D. | 标准状况下,4.48 L己烷含有的分子数为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=l的溶液中:Ca2+、Fe2+、NO3- | |
| B. | $\frac{Kw}{c(O{H}^{-})}$=10-2的溶液中:Na+、NH4+、Cl- | |
| C. | c(Fe3+)=0.1 mol.L-1的溶液中:K+、SCN-、SO42- | |
| D. | 由水电离的c(H+)=1×10-14 mol.L-1的溶液中:Na+、AlO2-、CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 X、Y、Z、M为前四周期中除氢以外原子序数依次增大的四种元素,X基态原子未成对电子数在所处周期中最多;Y元素原子核外共有3个能级,且最高能级电子数是前两个能级电子数之和;Z的单质常温下为淡黄色固体,ZY3分子呈平面正三角形;M原子外围电子排布式为3dn4sn.
X、Y、Z、M为前四周期中除氢以外原子序数依次增大的四种元素,X基态原子未成对电子数在所处周期中最多;Y元素原子核外共有3个能级,且最高能级电子数是前两个能级电子数之和;Z的单质常温下为淡黄色固体,ZY3分子呈平面正三角形;M原子外围电子排布式为3dn4sn.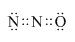 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com