
【题目】硫化氢的转化是资源利用和环境保护的重要研究课题。由硫化氢获得硫单质有多种方法。
(1)已知:H2S(g)+H2SO4(aq)=S(s)+SO2(g)+2H2O(l) ΔH1=61kJ·mol-1
SO2(g)+I2(g)+2H2O(l)=2HI(aq)+H2SO4(aq) ΔH2=-151kJ·mol-1
2HI(aq)=H2(g)+I2(g) ΔH3=110kJ·mol-1
则硫化氢气体分解为氢气和固体硫的热化学方程式为___。
(2)K2CO3溶液吸收H2S的反应为K2CO3+H2S![]() KHS+KHCO3,该反应的平衡常数的对数值为lgK=___
KHS+KHCO3,该反应的平衡常数的对数值为lgK=___
(已知:H2CO3lgK1=-6.4,lgK2=-10.3;H2SlgKl=-7.0,lgK2=-19.0)。
(3)工业上采用图1所示装置电解K4[Fe(CN)6]和KHCO3混合溶液一段时间,然后停止电解,通入H2S,利用生成的K3[Fe(CN)6]将H2S转化为S,自身转化为K4[Fe(CN)6]。
①电解时,阳极的电极反应式为___。
②通入H2S过程中,伴有CO![]() 转化为HCO
转化为HCO![]() 。通H2S发生反应的离子反应方程式为___。
。通H2S发生反应的离子反应方程式为___。

(4)将含H2S尾气的空气按一定流速通入酸性FeCl3溶液中,可实现含H2S尾气的空气脱硫。在FeCl3溶液吸收H2S的过程中,溶液中的n(Fe3+)及被吸收的n(H2S)随时间t的变化如图2所示。t1时刻后,溶液中n(Fe3+)保持微量减少至基本不变,其原因是___。

(5)H2S溶液中H2S、HS-,S2-的物质的量分数δ(X)随pH的变化如图3所示,H2S的电离平衡常数Ka1=___。写出pH由12.0变为16.0时发生的主要的离子方程式:___。

【答案】H2S(g)=H2(g)+S(s) ΔH=20kJ·mol-1 3.3 [Fe(CN)6]4--e-=[Fe(CN)6]3- 2[Fe(CN)6]3-+2CO![]() +H2S=2[Fe(CN)6]4-+2HCO
+H2S=2[Fe(CN)6]4-+2HCO![]() +S↓ t1时刻后,生成的Fe3+与H2S发生氧化还原反应,溶液中的Fe2+被空气氧化为Fe3+,这两个反应的速率近似相等,因而溶液中的Fe3+的量基本不变 10-7.24 HS-+OH-=S2-+H2O
+S↓ t1时刻后,生成的Fe3+与H2S发生氧化还原反应,溶液中的Fe2+被空气氧化为Fe3+,这两个反应的速率近似相等,因而溶液中的Fe3+的量基本不变 10-7.24 HS-+OH-=S2-+H2O
【解析】
(1)已知①H2S(g)+H2SO4(aq)=S(s)+SO2(g)+2H2O(l) ΔH1=61kJ·mol-1;
②SO2(g)+I2(g)+2H2O(l)=2HI(aq)+H2SO4(aq) ΔH2=-151kJ·mol-1;
③2HI(aq)=H2(g)+I2(g) ΔH3=110kJ·mol-1
根据盖斯定律,反应①+②+③得H2S(g)=H2(g)+S(s),ΔH=ΔH1+ΔH2+ΔH3=20kJ·mol-1,故答案为:H2S(g)=H2(g)+S(s) ΔH=20kJ·mol-1;
(2)根据题意,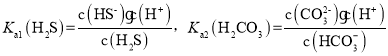 ,K2CO3溶液吸收H2S的反应为K2CO3+H2S
,K2CO3溶液吸收H2S的反应为K2CO3+H2S![]() KHS+KHCO3,离子方程式为
KHS+KHCO3,离子方程式为![]() +H2S
+H2S![]() HS-+
HS-+![]() ,则该反应的平衡常数为
,则该反应的平衡常数为 ,则lgK=lgKa1(H2S)-lgKa2(H2CO3)=-7-(-10.3)=3.3,故答案为:3.3;
,则lgK=lgKa1(H2S)-lgKa2(H2CO3)=-7-(-10.3)=3.3,故答案为:3.3;
(3)①电解时阳极发生失电子的氧化反应,先将[Fe(CN)6]4-转化为Fe(CN)6]3-,化合价升高,所以反应为:Fe(CN)6]4--e-=[Fe(CN)6]3-,故答案为:Fe(CN)6]4--e-=[Fe(CN)6]3-;
②通入H2S过程中,伴有CO![]() 转化为HCO
转化为HCO![]() ,根据电子得失守恒和元素守恒可知:2[Fe(CN)6]3-+2
,根据电子得失守恒和元素守恒可知:2[Fe(CN)6]3-+2![]() +H2S=2Fe[(CN)6]4-+2
+H2S=2Fe[(CN)6]4-+2![]() +S↓,故答案为:2[Fe(CN)6]3-+2
+S↓,故答案为:2[Fe(CN)6]3-+2![]() +H2S=2Fe[(CN)6]4-+2
+H2S=2Fe[(CN)6]4-+2![]() +S↓;
+S↓;
(4)t1时刻后,溶液中的Fe2+被空气氧化为Fe3+,生成的Fe3+再与H2S发生氧化还原反应,因而溶液中的Fe3+的量基本不变,故答案为:t1时刻后,生成的Fe3+与H2S发生氧化还原反应,溶液中的Fe2+被空气氧化为Fe3+,这两个反应的速率近似相等。因而溶液中的Fe3+的量基本不变;
(5)根据H2S溶液中H2S、HS-,S2-的物质的量分数δ(X)随pH的变化图,当pH=7.24时,c(H2S)=c(HS-),则H2S的电离平衡常数Ka1=c(H+)=10-7.24,由图可知,pH由12.0变为16.0时,是由HS-转化为了S2-,反应的离子方程式为HS-+OH-=S2-+H2O,故答案为:10-7.24;HS-+OH-=S2-+H2O。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】请回答:
(1)用氧化物表示翡翠:NaAl(SiO3)2的组成___________________。
(2)镁燃烧不能用CO2灭火,用化学方程式表示其理由___________________。
(3)在NaHSO4溶液中滴加Ba(OH)2溶液恰好完全沉淀,写出反应的离子方程式____________
(4)写出化学反应方程式
①煅烧黄铁矿__________________________。
②用氨气制硝酸的第一步__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关硫元素及其化合物的相关化学用语表示正确的是( )
A.质子数为16,中子数为16的硫原子:![]() S
S
B.硫化钠的电子式:![]()
C.二硫化碳分子的比例模型:![]()
D.NaHSO3电离方程式:NaHSO3=Na++H++SO![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下图所示的实验,回答问题:
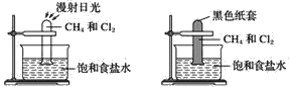
(1)装置A中的实验现象是____________________装置B中的实验现象是____
(2)根据上述实验,你能得出的结论是________________________________
(3)写出上述实验A中反应的化学方程式:
____________________________________________________;
____________________________________________________;
___________________________________________________;
______________________________________________________。
(4)上述反应的反应类型是________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在常温下的一密闭容器中事先放入1.56g过氧化钠,然后再通入乙烷与氧气的混合气体,用电火花引爆,直至反应完全为止,恢复到原温度,容器内压强近似为零。
(1)相同条件下,通入的气体氧气和乙烷的体积比是多少?_____
(2)通入氧气的质量最大应是多少?_____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下的某容积可变的密闭容器中,建立下列化学平衡:A(g)+3B(g)![]() 2C(g) ,能确定上述可逆反应在一定条件下已达到化学平衡状态的是
2C(g) ,能确定上述可逆反应在一定条件下已达到化学平衡状态的是
A.体系的压强不再发生变化B.3v正(B)=2v逆(C)
C.混合气体密度不再变化D.消耗1molA的同时生成2molC
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室中常用下列反应制取氯气:MnO2 + 4HCl(浓)![]() MnCl2 + Cl2↑+ 2 H2O
MnCl2 + Cl2↑+ 2 H2O
(1)用双线桥或单线桥的方式表示该反应电子转移的方向和数目:________
(2)该反应中还原剂是________;
(3)标准状况下,收集到2.24 L Cl2时,被氧化的还原剂的物质的量为_____mol,转移电子的物质的量为____mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】BMO(Bi2MoO6)是一种高效光催化剂,可用于光催化降解苯酚,反应原理如下图所示。下列说法错误的是
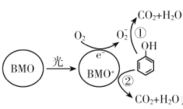
A.苯酚被氧化的总反应:C6H5OH+7O2![]() 6CO2+3H2O
6CO2+3H2O
B.反应过程中BMO表现较强氧化性
C.在酸性条件下,反应①的离子方程式是3C6H5OH+28![]() +28H+=l8CO2↑+23H2O
+28H+=l8CO2↑+23H2O
D.过程①和②中被降解的苯酚的物质的量之比为1:3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国秦俑彩绘和汉代器物上用的颜料被称为“中国蓝”、“中国紫”,近年来,人们对这些颜料的成分进行了研究,发现其成分主要为BaCuSi4O10、BaCuSi2O6。
(1)“中国蓝”、“中国紫”中均有Cun+离子,n=___________,基态时该阳离子的价电子排布式为___________。
(2)“中国蓝”的发色中心是以Cun+为中心离子的配位化合物,其中提供孤对电子的是____元素。
(3)已知Cu、Zn的第二电离能分别为1957.9kJ·mol-1、1733.3kJ·mol-1,前者高于后者的原因是________________________________________。
(4)铜常用作有机反应的催化剂。例如,2CH3CH2OH+O2![]() 2CH3CHO+2H2O。乙醛分子中碳原子的杂化轨道类型是___________;乙醛分子中σ键与π键的个数比为___________。
2CH3CHO+2H2O。乙醛分子中碳原子的杂化轨道类型是___________;乙醛分子中σ键与π键的个数比为___________。
(5)铜的晶胞如图所示。铜银合金是优质的金属材料,其晶胞与铜晶胞类似,银位于顶点,铜位于面心。

①该铜银合金的化学式是___________________。
②已知:该铜银晶胞参数为acm,晶体密度为ρg·cm-3。
则阿伏加德罗常数(NA)为_______mol-1(用代数式表示,下同)。
③若Ag、Cu原子半径分别为bcm、ccm,则该晶胞中原子空间利用率φ为___________。(提示:晶胞中原子空间利用率=![]() ×100%)
×100%)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com