
【题目】实验测得,某有机物A相对分子质量为72。
(1)若A是烃,其分子式为______,它有_____种同分异构体,沸点最高的是__________________ (写结构简式)。若该烃与Cl2发生取代反应,生成的一氯代物只有1种,则该A的结构简式为______。
(2)若该有机物3.6g完全燃烧生成0.15molCO2和0.1molH2O,则A的分子式为_______。若它是一种不饱和羧酸,该酸与甲醇发生酯化反应的化学方程式为(注明反应条件):__________________。
【答案】(1)C5H12;3;CH3CH2CH2CH2CH3; 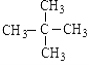 ;
;
(2)C3H4O2; ![]()
【解析】
试题分析:(1)若该有机物是烃,则![]() =5…2,故分子式为C5H12;同分异构体有正戊烷、异戊烷、新戊烷3种;由于烷烃同分异构体中,支链越多沸点越低,所以沸点最高的是正戊烷,该烃的结构简式为CH3CH2CH2CH2CH3;若该烃与Cl2发生取代反应,生成的一氯代物只有1种,则该烃的结构简式为C(CH3)4。
=5…2,故分子式为C5H12;同分异构体有正戊烷、异戊烷、新戊烷3种;由于烷烃同分异构体中,支链越多沸点越低,所以沸点最高的是正戊烷,该烃的结构简式为CH3CH2CH2CH2CH3;若该烃与Cl2发生取代反应,生成的一氯代物只有1种,则该烃的结构简式为C(CH3)4。
故答案为:C5H12;3;CH3CH2CH2CH2CH3;C(CH3)4;
(2)3.6g有机物中O元素质量为3.6g-0.15mol×12g/mol-0.1mol×2×1g/mol=1.6g,则氧原子物质的量为![]() =0.1mol,故分子中C、H、O原子数目之比为0.15:0.2:0.1=3:4:2,最简式为C3H4O2,相对分子质量为72,故分子式为C3H4O2;若它是一种不饱和羧酸,则其结构简式为CH2=CHCOOH,与甲醇发生酯化反应的化学方程式为:CH2=CHCOOH+CH3OH
=0.1mol,故分子中C、H、O原子数目之比为0.15:0.2:0.1=3:4:2,最简式为C3H4O2,相对分子质量为72,故分子式为C3H4O2;若它是一种不饱和羧酸,则其结构简式为CH2=CHCOOH,与甲醇发生酯化反应的化学方程式为:CH2=CHCOOH+CH3OH![]() CH2=CHCOOCH3+H2O。
CH2=CHCOOCH3+H2O。
故答案为:C3H4O2;CH2=CHCOOH+CH3OH![]() CH2=CHCOOCH3+H2O。
CH2=CHCOOCH3+H2O。


 特高级教师点拨系列答案
特高级教师点拨系列答案 文敬图书课时先锋系列答案
文敬图书课时先锋系列答案科目:高中化学 来源: 题型:
【题目】人们常用空气污染指数API(Air Pollution Index)来表示空气的质量。某地区各种污染指数分别为:二氧化硫95,二氧化氮48,可吸入颗粒物55。则该地区的空气污染指数为( )
A.48 B.55 C.95 D.198
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生利用下面实验装置探究盐桥式原电池的工作原理(Cu 64)。
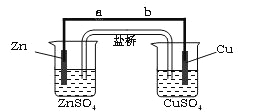
按照实验步骤依次回答下列问题:
(1)导线中电子流向为 (用a、b 表示)。
(2) 写出装置中锌电极上的电极反应式: ;
(3)若装置中铜电极的质量增加0.64g,则导线中转移的电子数目为 ;(不许用“NA”表示 )
(4)装置中盐桥中除添加琼脂外,还要添加KCl的饱和溶液,电池工作时,对盐桥中的K+,Cl-的移动方向描述正确的是 。
A.盐桥中的K+向左侧烧杯移动、Cl-向右侧烧杯移动
B.盐桥中的K+向右侧烧杯移动、Cl-向左侧烧杯移动
C.盐桥中的K+、Cl-都向右侧烧杯移动
D.盐桥中的K+、Cl-几乎都不移动
(5)若ZnSO4溶液中含有杂质Cu2+,会加速Zn电极的腐蚀、还可能导致电流在较短时间内衰减。欲除去Cu2+,最好选用下列试剂中的 (填代号)。
A. NaOH B.Zn C.Fe D.H2SO4
(6)反应一段时间后右侧烧杯中Cu2+浓度是 (填增大 减小或不变)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[物质结构与性质]
丁二酮肟![]() 是检验Ni2+的灵敏试剂。
是检验Ni2+的灵敏试剂。
(1)Ni2+基态核外电子排布式为 。丁二酮肟分子中C原子轨道杂类型为 ,1mol丁二酮肟分子所含![]() 键的数目为 。
键的数目为 。
(2)Ni能与CO形成四羰基镍[Ni(CO)4],四羰基镍熔点-19.3℃,沸点42.1℃,易溶于有机溶剂。
①Ni(CO)4固态时属于 晶体(填晶体类型)。
②与CO互为等电子体的阴离子为 (填化学式)。
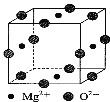
(3)Ni2+与Mg2+、O2—形成晶体的晶胞结构如图所示(Ni2+未画出),则该晶体的化学式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关晶体的下列说法中正确的是
A.晶体中分子间作用力越大,分子越稳定
B.原子晶体中共价键越强,熔点越高
C.冰熔化时水分子中共价键发生断裂
D.氯化钠熔化时离子键未被破坏
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溴苯是一种化工原料,实验室合成溴苯的装置示意图如图所示,物质的有关数据信息如下表,请按下列合成步骤回答问题:
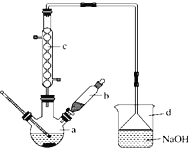
苯 | 溴 | 溴苯 | |
密度/gcm3 | 0.88 | 3.10 | 1.50 |
沸点/C | 80 | 59 | 156 |
水中溶解度 | 微溶 | 微溶 | 微溶 |
(1)在a中加入15mL无水苯和少量铁屑。在b中小心加入4.0mL液态溴。 向a中滴入几滴溴,有白色烟雾产生,是因为生成了______气体。继续滴加至液溴滴完。装置d的作用是_________;
(2) 液溴滴完后,经过下列步骤分离提纯:
①向a中加入10mL水,然后过滤除去未反应的铁屑;
②滤液依次用10mL水、8mL10%的NaOH溶液、10mL水洗涤,NaOH 溶液洗涤的作用是___________;
③向分出的粗溴苯中加入少量的无水氯化钙,静置、过滤。加入氯化钙的目的是_____________________;
(3)经以上分离操作后,粗溴苯中还含有的主要杂质为______,要进一步提纯,下列操作中必须的是______;(填入正确选项前的字母)
A.重结晶 B. 过滤 C. 蒸馏 D. 萃取
(4)在该实验中,a的容积最适合的是______.(填入正确选项前的字母)
A. 25mL B. 50mL C. 250mL D. 500mL.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】原子序数依次增大的A、B、C、D、E、F六种元素。其中A的基态原子有3个不同的能级,各能级中的电子数相等;C的基态原子2p能级上的未成对电子数与A原子的相同:D为它所在周期中原子半径最大的主族元素;E和C位于同一主族,F的原子序数为25。
(1)F基态原子的核外电子排布式为 。
(2)在A、B、C三种元素中,第一电离能由小到大的顺序是(用元素符号回答) 。
(3)元素B的简单气态氢化物的沸点远高于元素A的简单气态氢化物的沸点,其主要原因是 。
(4)由A、B、C形成的离子CAB-与AC2互为等电子体,则CAB-的结构式为 。
(5)在元素A与E所形成的常见化合物中,A原子轨道的杂化类型为 。
(6)由B、C、D三种元素形成的化合物晶体的晶胞如图所示,则该化合物的化学式为 。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】综合利用CO2、CO对构建低碳社会有重要意义。
(1)利用H2 和CO在一定条件下发生如下反应:CO(g)+2H2(g)![]() CH3OH(g)(放热反应)。对此反应进行如下研究:在恒温,体积为2L的密闭容器中分别充入1.2mol CO和1mol H2,10min后达到平衡,测得含有0.4mol CH3OH(g)。
CH3OH(g)(放热反应)。对此反应进行如下研究:在恒温,体积为2L的密闭容器中分别充入1.2mol CO和1mol H2,10min后达到平衡,测得含有0.4mol CH3OH(g)。
①10min后达到平衡时CO的浓度为 ;
②10min内用H2表示的平均反应速率为 ;
③若要加快CH3OH的生成速率,可采取的措施有 (填一种合理的措施)
(2)利用H2 和CO2在一定条件下可以合成乙烯:6H2+2CO2![]() CH2=CH2+4H2O
CH2=CH2+4H2O
①已知:4.4gCO2与H2完全转化为CH2=CH2和水(气态)共放出6.39kJ的热量,写出该反应的热化学方程式 。
②不同温度对CO2的转化率及催化剂的催化效率的影响如图甲所示。
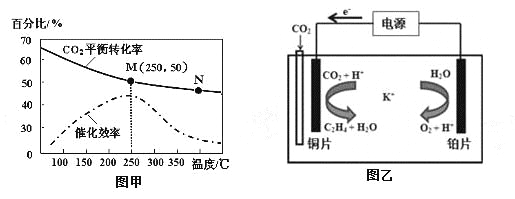
下列有关说法不正确的是 (填序号)。
A.不同条件下反应,N点的速率最大
B.温度在约250℃时,催化剂的催化效率最高
C.相同条件下,乙烯的产量M点比N高
③若在密闭容器中充入体积比为 3∶1的 H2和CO2,则图甲中M点时,产物CH2=CH2的体积分数为 。(保留两位有效数字)
(3)利用一种钾盐水溶液作电解质,CO2电催化还原为乙烯,如图乙所示。在阴极上产生乙烯的电极反应方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示中,A为一种常见的单质,B、C、D、E是含A元素的常见化合物,它们的焰色反应均为黄色。
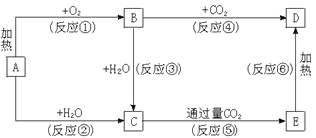
请填写下列空白:
(1)C的电子式______________,B的电子式______________,D的化学式_______________。
(2)以上反应中属于氧化还原反应的有____________________(填写编号)。
(3)写出B→D的化学方程式___________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com