
下列离子方程式正确的是( )
A.用食醋除去水壶内的水垢:CaCO3+2H+===Ca2++CO2↑+H2O
B.用惰性电极电解饱和氯化镁溶液:
2Cl-+2H2O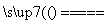 2OH-+H2↑+Cl2↑
2OH-+H2↑+Cl2↑
C.少量Cl2通入FeBr2溶液中:2Br-+Cl2===2Cl-+Br2
D.过量NaHSO4溶液加入到Ba(OH)2溶液中:
2H++SO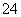 +Ba2++2OH-===2H2O+BaSO4↓
+Ba2++2OH-===2H2O+BaSO4↓
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
)四种短周期元素W、X、Y、Z,原子序数依次增大,请结合表中信息回答下列问题。
| W | X | Y | Z | |
| 结构或性质 | 最高价氧化物对应的水化物与其气态氢化物反应得到离子化合物 | 焰色反应呈黄色 | 在同周期主族元素形成的简单离子中,离子半径最小 | 最高正价与最低负价之和为零 |
(1)Z在元素周期表中位于 族。
(2)上述元素的最高价氧化物对应的水化物中,有一种物质在一定条件下均能与其他三种物质发生化学反应,该元素是 (填元素符号)。
(3)①下列可作为比较X和Y金属性强弱的依据的是 (填序号)。
a.自然界中的含量
b.相应氯化物水溶液的pH
c.单质与水反应的难易程度
d.单质与酸反应时失去的电子数
②从原子结构的角度解释X的金属性强于Y的原因:______________________,
原子半径X>Y,所以原子核对最外层电子的吸引力X<Y,失电子能力X>Y。
(4)W的一种氢化物HW3可用于有机合成,其酸性与醋酸相似。体积和浓度均相等的HW3与X的最高价氧化物对应的水化物的溶液混合,反应的化学方程式是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA为阿伏加德罗常数的值。下列叙述正确的是( )
A.标准状况下,2.24 L水中所含电子总数为NA
B.1 L 0.2 mol·L-1硫酸铁溶液中含有的SO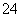 数目为0.6NA
数目为0.6NA
C.1 mol苯和苯甲酸的混合物完全燃烧时消耗O2的分子数为7.5NA
D.标准状况下,7.1 g氯气与足量石灰乳充分反应转移电子数为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
相同温度和压强下,在容积为2 L的密闭容器中发生反应:2HI(g) H2(g)+I2(g),达到平衡状态的标志是
H2(g)+I2(g),达到平衡状态的标志是
A.c(H2)保持不变
B.拆开2 mol H-I共价键,同时生成1 mol H-H共价键
C.HI、H2、I2的浓度比为2:1:1
D.正反应和逆反应都已停止
查看答案和解析>>
科目:高中化学 来源: 题型:
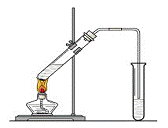 “酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如右图所示的装置制取乙酸乙酯。回答下列问题:
“酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如右图所示的装置制取乙酸乙酯。回答下列问题:
(1)写出制取乙酸乙酯的化学反应方程式
(2)浓硫酸的作用是:① ;② 。
(3)饱和碳酸钠溶液的主要作用是
。
装置中通蒸气的导管要插在饱和碳酸钠溶液的液面上,不能插入溶液中,目的是 。
若要把制得的乙酸乙酯分离出来,应采用的实验操作是
查看答案和解析>>
科目:高中化学 来源: 题型:
对某酸性溶液(可能含有Br-,SO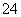 ,H2SO3,NH
,H2SO3,NH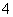 )分别进行如下实验:
)分别进行如下实验:
①加热时放出的气体可以使品红溶液褪色;
②加碱调至碱性后,加热时放出的气体可以使润湿的红色石蕊试纸变蓝;
③加入氯水时,溶液略显黄色,再加入BaCl2溶液,产生的白色沉淀不溶于稀硝酸。
对于下列物质不能确认其在原溶液中是否存在的是( )
A.Br- B.SO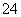 C.H2SO3 D.NH
C.H2SO3 D.NH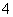
查看答案和解析>>
科目:高中化学 来源: 题型:
某元素只存在2种天然同位素,且在自然界它们的含量相近,其相对原子质量为152.0,原子核外的电子数为63.下列叙述错误的是( )
A.它是副族元素 B.它是第六周期元素
C.它的原子核内有63个质子 D.它的一种同位素的核内有89个中子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com