
����Ŀ������ϩ(![]() )�Ǻϳ���֬�����ӽ�����֬���ϳ��ȵ���Ҫ���塣
)�Ǻϳ���֬�����ӽ�����֬���ϳ��ȵ���Ҫ���塣
��1��������������ʹ��ˮ�����ӳɷ�Ӧ����ɫ����_______(�����)����д������һ����Ӧ�Ļ�ѧ����ʽ��_________________________��
A.NaOH ��Һ B.�� C.������̼ D.��ϩ E.����ϩ F.�⻯����Һ
��2����ҵ�����ұ�(C6H5-CH2CH3)Ϊԭ�ϣ����ô�����ķ�����ȡ����ϩ(C6H5-CH=CH2)�ķ�Ӧ����ʽΪC6H5-CH2CH3(g) ��C6H5-CH=CH2(g)+ H2(g) ��H1�������ΪVL���ܱ������г���amol�ұ�����Ӧ�ﵽƽ��״̬ʱ��ƽ����ϵ���(���ʵ�������)���¶ȵĹ�ϵ��ͼ��ʾ��

����.a��b��c��d�ֱ�����600�� ʱ����������(�������)�Ľ��㣬���߶�ab��bc��cd=1��1��2����:
�����¶����ұ���ƽ��ת����Ϊ_______________��
�����¶��·�Ӧ��ƽ�ⳣ��Ϊ____________������ʱ��ƽ�ⳣ��_________(���� �������������������С��)��
��Ҫʹ������Ӧ������Ӧ���ʺ��ұ���ת����ͬʱ�������д�ʩ���е���_____________(�����)��
A.���˴��� B.����C6H5-CH2CH3�����ʵ���Ũ�� C �����¶�
D.��СH 2��Ũ�� E.����ϡ�ͼ�ˮ������������ϵ��ѹ
(3)��֪:C6H6(g)![]() 3C2H2(g) ��H2
3C2H2(g) ��H2
C6H6(g)+ C2H4(g)![]() C6H5-CH=CH2 (g) ��H3
C6H5-CH=CH2 (g) ��H3
��Ӧ3C2H2(g)+ C2H4(g) ![]() C6H5-CH=CH2 (g)����H=_______________��
C6H5-CH=CH2 (g)����H=_______________��
���𰸡� DE CH2=CH2+Br2��CH2BrCH2Br 33% a/6V ��С C ��H3-��H2
����������1��A.NaOH��Һ����ˮ����������ԭ��Ӧ�� B.��������ȡ��ˮ�е��壬���ǻ�ѧ��Ӧ�� C.������̼ ������ȡ��ˮ�е��壬���ǻ�ѧ��Ӧ D.��ϩ ����ˮ�����ӳɷ�Ӧ��E.����ϩ����ˮ�����ӳɷ�Ӧ�� F.�⻯����Һ����ˮ����������ԭ��Ӧ�����Դ𰸣�DE
��2��ab��bc��cd=1��1��2��֪ƽ����ϵ�б���ϩ�����ʵ�������Ϊ![]() ,
,
�� ![]()
![]()
��ʼ�� a mol 0 0
�仯�� x mol x molx mol
ƽ����![]() x mol x mol
x mol x mol
�������֪��:![]() ,��
,��![]() ,
,
�ұ���ƽ��ת����Ϊ![]() ,��ˣ�������ȷ����:33
,��ˣ�������ȷ����:33![]()
�� ![]()
![]()
![]() (g)
(g)![]()
![]() (g)
(g)![]()
��ʼŨ��/(![]() 0 0
0 0
�仯Ũ��/(![]()
![]()
![]()
ƽ��Ũ��/(![]()
![]()
![]()
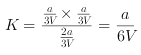 ,��ˣ�������ȷ����:
,��ˣ�������ȷ����:![]() ;
;
��ͼ��֪�¶���������ƽ�������������������,ƽ�������ƶ�,����ӦΪ���ȷ�Ӧ���¶ȵĽ��ͣ�ƽ�������ƶ���ƽ�ⳣ����С���𰸣���С��
��A.���˴��� �ı䷴Ӧ���ʣ����ı�ƽ���ƶ�����A���� B.����C6H5-CH2CH3�����ʵ���Ũ�ȼӿ�����Ӧ���ʣ����ұ���ת���ʽ��ͣ��ʴ��� C�����¶ȷ�Ӧ���ʼӿ죬ƽ�������ƶ����ұ���ת����������D.��СH2��Ũ�ȷ�Ӧ���ʽ��ͣ��ʴ��� E.������ϵ��ѹ����ͬ�¶���,����Ӧ��ϵ�м���ϡ�ͼ�,����ƽ���ƶ�ԭ��,����������ӵķ����ƶ�,�������ƶ�,ת��������������Ӧ��ѹǿ���ͣ����ʼ���������E�����𰸣�C��
��3���ɸ�˹���ɿ���֪����֪:
��C6H6(g)![]() 3C2H2(g) ��H2 ��C6H6(g)+ C2H4(g)
3C2H2(g) ��H2 ��C6H6(g)+ C2H4(g)![]() C6H5-CH=CH2 (g) ��H3
C6H5-CH=CH2 (g) ��H3
��-�� 3C2H2(g)+ C2H4(g) ![]() C6H5-CH=CH2 (g) ��H=��H3- ��H2
C6H5-CH=CH2 (g) ��H=��H3- ��H2
�ʴ𰸣���H=��H3- ��H2


 ͬ������ϵ�д�
ͬ������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ���¶���(T2> Tl)����3�������Ϊ2.0 L�ĺ����ܱ������з�Ӧ 2NO(g)+ Cl2(g) = 2ClNO(g)������Ӧ���ȣ��ﵽƽ�⣬����˵����ȷ����

A. �ﵽƽ��ʱ������I������II�е���ѹǿ֮��Ϊ1��2
B. �ﵽƽ��ʱ������III��ClNO��ת����С��80%
C. �ﵽƽ��ʱ������II��c(ClNO(/ c(NO)������I�еĴ�
D. ���¶�ΪTl����ʼʱ��ͬ��������ܱ������г���0.20 mol NO(g)��0.2 mol Cl2(g)��0.20 mol ClNO(g)����÷�Ӧ������Ӧ�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ͨ�����з�ɢϵʱ���ɹ۲쵽�����ЧӦ���ǣ� ��
A.�Ҵ���Һ
B.�Ȼ�����Һ
C.����ͭ��Һ
D.������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и������ʰ������ᡢ��˳�����е��ǣ� ��
A.�ɱ������ᡢ������
B.��ˮ�������ᡢ������ͭ
C.����ˮ������ͭ����������
D.ˮ���������ᡢ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼΪ����0.2molL��1Na2CO3��Һ250mLʾ��ͼ��

�ش��������⣺
��1�����гƵ�Na2CO3 g��
��2���������������������е����÷ֱ��� �� ��
��3�������������������������ҺŨ���к�Ӱ�죿������ƫ��������ƫ����������Ӱ������
A��ijͬѧ�ڵ������۲�Һ��ʱ���� ��
B��û�н��в������������� ��
C���ڵ���������������Һ����������ƿ�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����״���£���һ������ˮ���հ������Ƶ�Ũ��Ϊ12.0 mol��L��1���ܶ�Ϊ0.915 g��cm��3�İ�ˮ���Լ���1���ˮ���ն�������İ������Ƶ�������ˮ���������а���ʽ���� 17.0�ƣ���ˮ���������ܽ��NH3Ϊ��ˮ���ܶ���1.00g��cm��3�ƣ�_______________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ����ʵ�����Ƶõ���ϩ��C2H5OH![]() CH2=CH2��+H2O������ˮ������ȡ1��2����������IJ���װ��ͼ������ͼʾ�ж�����˵����ȷ����
CH2=CH2��+H2O������ˮ������ȡ1��2����������IJ���װ��ͼ������ͼʾ�ж�����˵����ȷ����

A. װ������װ�����ж�ʢ��ˮ����������ͬ
B. װ������װ�����ж�ʢ��NaOH��Һ�������յ�������ͬ
C. ������÷�Һ�ķ������з��룬1��2����������Ӧ�ӷ�Һ©�����Ͽڵ���
D. �Ʊ���ϩ������1��2����������ķ�Ӧ���ͷֱ�����ȥ��Ӧ�ͼӳɷ�Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���л���G�Ǻϳ�ij�����Ⱦۺ���ĵ��壬��ϳɷ������£�

��֪��R1COOR2+R3OH ![]() RCOOR3+R2OH
RCOOR3+R2OH
��1������ϵͳ��������A������Ϊ___ ��
��2�����������е�ȡ����Ӧ���ڡ������___������ţ����ڢݲ���Ӧ�У���ʹ�ú���18O��F����֮��C��Ӧ������������18O�ķֲ�������Ӷ��ƶϷ�Ӧ�����������о�������Ϊ___ ��
��3��������E�ĺ˴Ź�������ͼ�й��ж�����շ壬����ķ������Ϊ___ ��
��4�������кϳ�·�߿ɵõ�F��ͬ���칹��H����ɼ���H��F���Լ���___ ��

��5��C������NaOH��Һ��Ӧ�Ļ�ѧ����ʽΪ___ ��
��6��J��C��Ϊͬ���칹�壬������������ʣ�����Ҫ����л�����___�֣������������칹��
������NaOH��Һ��Ӧ����1mol J��ȫ��Ӧ����4mol NaOH
���ܷ���������Ӧ����1mol J��������������Һ��Ӧ����4mol Ag
�۷����б����ϵ�һ��ȡ����ֻ��һ�֣�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���20 mL 0.1 molL-1��ˮ��Һ�еμ�һ��Ũ�ȵ�ϡ���ᣬ��Һ����ˮ�����������Ũ���������������ı仯��ͼ��ʾ��
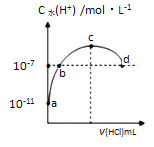
������˵����ȷ����
A. �����£�0.1molL-1��ˮ�ĵ��볣��KԼΪ1��10-5molL-1
B. a��b֮��ĵ�һ�����㣺c(NH4��)��c(Cl��)��c(OH��)��c(H��)
C. c����Һ��c(NH4��)=c(Cl��)
D. d���������Һǡ����ȫ��Ӧ
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com