
【题目】水是极弱的电解质,改变温度或加入某些电解质会影响水的电离。请回答下列问题:
(1)纯水在100 ℃时,pH=6,该温度下0.1 mol·L-1的NaOH溶液的pH=________。
(2)25 ℃时,向水中加入少量碳酸钠固体,得到pH为11的溶液,其水解的离子方程式为_________________,由水电离出的c(OH-)=________ mol·L-1。
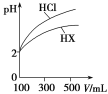
(3)体积均为100 mL、pH均为2的盐酸与一元酸HX,加水稀释过程中pH与溶液体积的关系如图所示,则HX是________(填“强酸”或“弱酸”),理由是______________________________。
(4)电离平衡常数是衡量弱电解质电离程度强弱的物理量。已知:
化学式 | 电离平衡常数(25 ℃) |
HCN | K=4.9×10-10 |
CH3COOH | K=1.8×10-5 |
H2CO3 | K1=4.3×10-7、K2=5.6×10-11 |
①25 ℃时,等浓度的NaCN溶液、Na2CO3溶液和CH3COONa溶液,溶液的pH由大到小的顺序为________(填化学式)。
②25 ℃时,在0.5 mol·L-1的CH3COOH溶液中由CH3COOH电离出的c(H+)约是由水电离出的c(H+)的________倍。
【答案】(1)11 (2)CO![]() +H2OHCO
+H2OHCO![]() +OH- 10-3 (3)弱酸 稀释相同倍数,一元酸HX的pH变化量比HCl的小,说明HX存在电离平衡,故HX为弱酸 (4)①Na2CO3>NaCN>CH3COONa ②9×108
+OH- 10-3 (3)弱酸 稀释相同倍数,一元酸HX的pH变化量比HCl的小,说明HX存在电离平衡,故HX为弱酸 (4)①Na2CO3>NaCN>CH3COONa ②9×108
【解析】(1)根据题意可知,c(OH-)=0.1 mol·L-1,该温度下,Kw=c(H+)·c(OH-)=10-12,则c(H+)=10-11 mol·L-1,pH=11。(2)碳酸根离子水解的离子方程式为CO![]() +H2OHCO
+H2OHCO![]() +OH-,pH=11说明c(H+)=10-11 mol·L-1,c(OH-)=
+OH-,pH=11说明c(H+)=10-11 mol·L-1,c(OH-)=![]() mol·L-1=10-3 mol·L-1,溶液中的OH-全部是由水电离产生的。(4)①酸的酸性越弱,其对应的盐的水解程度越大,碱性越强,pH越大,由表知酸性:CH3COOH>HCN>HCO
mol·L-1=10-3 mol·L-1,溶液中的OH-全部是由水电离产生的。(4)①酸的酸性越弱,其对应的盐的水解程度越大,碱性越强,pH越大,由表知酸性:CH3COOH>HCN>HCO![]() ,则pH:Na2CO3>NaCN>
,则pH:Na2CO3>NaCN>
CH3COONa。②由CH3COOH的电离平衡常数的定义得Ka(CH3COOH)=![]() =
=![]() =1.8×10-5,c(CH3COOH)≈0.5 mol·L-1,则c(H+)≈3×10-3 mol·L-1,由水电离出的氢离子浓度约为
=1.8×10-5,c(CH3COOH)≈0.5 mol·L-1,则c(H+)≈3×10-3 mol·L-1,由水电离出的氢离子浓度约为![]() mol·L-1,故由CH3COOH电离出的c(H+)约是由水电离出的c(H+)的
mol·L-1,故由CH3COOH电离出的c(H+)约是由水电离出的c(H+)的 =9×108倍。
=9×108倍。


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:
【题目】化学实验室产生的废液中含有大量会污染环境的物质,为了保护环境,化学实验室产生的废液必须经处理后才能排放。某化学实验室产生的酸性废液中含有Fe3+、Cu2+、Ba2+三种金属阳离子和Cl-一种阴离子,实验室设计了下述方案对废液进行处理,以回收金属并测定含量,保护环境。

已知实验中处理的酸性废液的体积为1L,用pH计测定出其中H+物质的量浓度为0.10mol/L。
请回答下列问题:
(1)实验中操作I、II、III的方法相同,操作步骤依次为过滤、_________、干燥。
(2)“氧化”步骤所得溶液颜色为棕黄色,该反应的离子方程式为:__________。
(3)实验中称量固体I 的质量为4.66g,固体II 的质量为15.2g,用足量的稀硝酸溶解固体II 后产生了标准状况下的无色气体4.48L,则固体II 中金属铜的质量为________g。
(4)实验中将固体III进行充分灼烧,使用仪器除了酒精灯、三脚架、泥三角、玻璃棒外,还有_____(填名称)。最后得到的红棕色固体质量为40.0g,则原溶液中氯离子的物质的量浓度为________(写出计算过程)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列推理正确的是( )
A.铝粉在氧气中燃烧生成Al2O3,故钠在氧气中燃烧生成Na2O
B.铁能从硫酸铜溶液中置换出铜,故钠也能从硫酸铜溶液中置换出铜
C.活泼金属钠保存在煤油中,故活泼金属铝也保存在煤油中
D.钠与氧气、水等反应时钠均作还原剂,故金属单质参与反应时金属单质均作还原剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将下列物质按酸、碱、盐分类依次排列正确的是( )
A.硫酸、纯碱、石灰石
B.氢硫酸、烧碱、绿矾
C.石炭酸、熟石膏、醋酸钠
D.磷酸、乙醇钠、苛性钾
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下表是A、B、C、D四种有机物的有关信息:
A | ①能使溴的四氯化碳溶液退色;②比例模型为 |
B | ①由C和H两种元素组成;②比例模型为 |
C | ①由C、H、O三种元素组成;②能与Na反应,但不能与NaOH溶液反应;③能与D反应生成相对分子质量为100的酯 |
D | ①由C、H、O三种元素组成;②球棍模型为 |
回答下列问题:
①A与Br2的CCl4溶液反应的生成物的名称是________________。
②B不能使溴水因发生化学反应而褪色,B与一定比例浓硫酸和浓硝酸的混合溶液发生反应,为了使反应在50~60 ℃下进行,常用的方法是_____________;反应方程式为: ________________________________,反应类型为:________反应。
③C和D反应生成相对分子质量为100的酯,生成的酯的结构简式:______。
(2)已知: A是石油裂解气的主要成份,A的产量通常用来衡量一个国家的石油化工水平;由A通过聚合反应生成高分子化合物F,F可用于工业合成塑料,现以A为主要原料合成G, 以A为原料的合成路线如下图所示。

回答下列问题:
①D、G分子中的官能团名称分别__________、___________。
②在反应①~⑥中,属于加成反应的是________,属于取代反应的是________。(填序号)
③写出与G分子式相同的所有羧酸类的同分异构体:_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下列物质转化中,A是一种酸式盐,D的相对分子质量比C的相对分子质量大16,E是酸,当X无论是强酸还是强碱时,都有如下的转化关系:
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
当X是强酸时,A、B、C、D、E均含同一种元素;当X是强碱时,A、B、C、D、E均含另外同一种元素。请回答:
(1)A是________, Z是________。
(2)当X是强酸时,写出B生成C的化学方程式:___________________。
(3)当X是强碱时,E是________,写出E和铜反应生成C的化学方程式:__________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com