
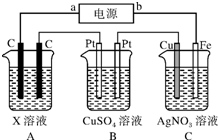
 如图所示,电解一段时间后,测得C中Ag+减少了0.1mol,Fe电极被溶解.试回答:
如图所示,电解一段时间后,测得C中Ag+减少了0.1mol,Fe电极被溶解.试回答:分析 (1)有外接电源,都是电解池,C中Fe电极溶解,则C作阳极,与阳极相连的是电源的正极;
(2)根据电子转移守恒计算B中铜离子的物质的量,再根据公式c=$\frac{n}{V}$计算;根据析出什么加什么的原则分析;
(3)C中Ag+减少了0.1mol,转移电子0.1mol,盐酸溶液中是氢离子和氯离子放电产生氢气和氯气,根据电极反应关系式计算气体总体积;计算溶液中剩下氢离子浓度得出PH.
解答 解:(1)图中有外接电源,都是电解池,C中Fe电极溶解,则C作阳极,阳极铁失电子发生氧化反应,电极反应为Fe-2e-═Fe2+,与阳极相连的是电源的正极,故答案为:正;Fe-2e-═Fe2+;
(2)当C中Ag+减少0.1mol时,转移电子0.1mol,B中Cu2+恰好完全析出为Cu,电极反应为:Cu2++2e-═Cu,则B中铜离子的物质的量为$\frac{0.1mol}{2}$=0.05mol,溶液中硫酸铜的c=$\frac{n}{V}$=$\frac{0.05mol}{0.1L}$=0.5mol/L,电解硫酸铜溶液的总反应为:2Cu2++2H2O$\frac{\underline{\;电解\;}}{\;}$2Cu+O2 ↑+4H+,析出铜和氧气,要使溶液复原则可加氧化铜和碳酸铜,氧化铜与氢离子反应生成铜离子和水,碳酸铜与氢离子反应生成铜离子和水,二氧化碳溢出,
故答案为:0.5mol/L;CuO或CuCO3;
(3)C中Ag+减少了0.1mol,转移电子0.1mol,盐酸溶液中是氢离子和氯离子放电产生氢气和氯气,100mL 1.1mol/L的HCl溶液中氢离子物质的量为0.11mol,盐酸过量,2H+~H2~2e-,Cl2~2e-,则产生的气体有$\frac{0.1mol}{2}$$+\frac{0.1mol}{2}$=0.1mol,在标准状况下的总体积为0.1mol×22.4L/mol=2.24L;此时溶液中剩下氢离子物质的量为0.11mol-0.1mol=0.01mol,氢离子的浓度为0.01mol÷0.1L=0.1mol/L,PH=1,
故答案为:2.24L;1.
点评 本题以电解原理为载体考查了电极反应式的书写、离子浓度的计算,难度不大,利用电子转移守恒计算是解题的关键.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ;
; ;
; ;
; ;
; ;
; ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 明矾净水 | |
| B. | 使用热的纯碱溶液去除油污 | |
| C. | 实验室配制FeCl3溶液时加入少量稀盐酸 | |
| D. | 实验室制氢气时加入CuSO4可加快反应速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 聚乙烯塑料制品可用于食品的包装 | |
| B. | 石油催化裂化的主要目的是提高汽油等轻质油的产量与质量 | |
| C. | 原电池放电发生化学变化,同时能量发生转化 | |
| D. | 开发太阳能,推广使用甲醇汽油,使用无磷洗涤剂都可直接降低碳排放 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验室用Zn和稀硝酸制取H2:Zn+2H+═Zn2++H2↑ | |
| B. | H2SO4溶液中和Ba(OH)2溶液:H++SO42-+Ba2++OH-═H2O+BaSO4↓ | |
| C. | 向Ca(HCO3)2溶液中加入过量NaOH溶液:Ca2++2HCO3-+2OH-═CaCO3↓+CO32-+2H2O | |
| D. | 向苯酚钠溶液中通入少量的CO2:2C4H3O-+CO2+H2O═2C6H5OH+CO3-2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 100 mL | B. | 200 mL | C. | 300 mL | D. | 400 mL |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com