
【题目】常温时,用0.1000mol/L NaOH溶液滴定25.00mL 0.1000mol/L某一元酸HX溶液,滴定过程中pH变化曲线如图所示.下列说法不正确的是( ) 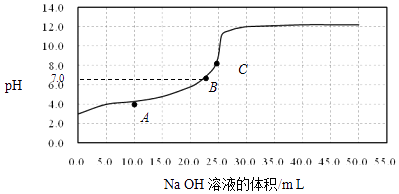
A.在A点:c(HX)>c(Na+)>c(X﹣)
B.在B点,溶液中c(H+)=c(OH﹣)
C.C点溶液中存在的主要平衡是X﹣+H2OHX+OH﹣
D.0.05mol/L NaX溶液的pH≈9
科目:高中化学 来源: 题型:
【题目】下列各组变化中,只有加入酸才能一步实现的是( )
A. Zn→ZnSO4 B. CuO→CuCl2
C. CaCO3→CO2 D. NaOH→Na2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定体积的密闭容器中,进行如下化学反应:CO(g)+H2O (g)CO2(g)+H2(g),其化学平衡常数K和温度t的关系如表:
t℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K= , 该反应为反应(填吸热或放热).若改变条件使平衡向正反应方向移动,则平衡常数(填序号)
①一定不变 ②一定减小 ③可能增大 ④增大、减小、不变皆有可能
(2)能判断该反应是否达到化学平衡状态的依据是 .
(a)容器中压强不变 (b)混合气体中c(CO)不变
(c)v逆(H2)=v正(H2O) (d)c(CO)=c(CO2)
(3)将不同量的CO (g) 和H2O (g) 分别通入到体积为2L的恒容密闭容器中,进行反应CO (g)+H2O (g)CO2(g)+H2(g),得到如表三组数据:
实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
H2O | CO | CO2 | CO | |||
A | 650 | 2 | 4 | 1.6 | 2.4 | 5 |
B | 900 | 1 | 2 | 0.4 | 1.6 | 3 |
C | 1000 | 1 | 2 | c | d | t |
①实验B中平衡时H2O (g)的物质的量是 .
②通过计算可知,CO的转化率实验A实验B(填“大于”、“等于”或“小于”).
③若实验C中达到平衡所需时间 t3(填“大于”、“等于”或“小于”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】粗盐中含可溶性CaCl2、MgCl2及一些硫酸盐,除去这些杂质的试剂可选用①Na2CO3、②NaOH、③BaCl2、④HCl,加入的先后顺序可以是( )
A.①②③④B.②③①④C.②①③④D.③②④①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A.1molCO2 的质量为44g/mol
B.物质的量就是物质的质量
C.气体摩尔体积约为22.4L/mol
D.NA个CO2的质量(以克为单位)与CO2的相对分子质量在数值上相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】纯碱是重要的化工原料,在医药、冶金、化工、食品等领域被广泛使用.
(1)工业生产纯碱的第一步是除去饱和食盐水的中Mg2+、Ca2+离子,从成本角度考虑加入试剂的化学式为、 . 某实验小组的同学模拟侯德榜制碱法制取纯碱,流程如图1: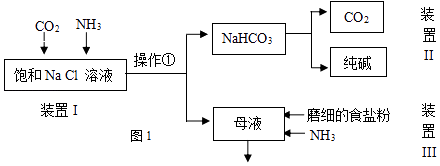
已知:几种盐的溶解度
NaCl | NH4HCO3 | NaHCO3 | NH4Cl | |
溶解度(20°C,100gH2O时) | 36.0 | 21.7 | 9.6 | 37.2 |
(2)①写出装置I中反应的化学方程式 . ②从平衡移动角度解释该反应发生的原因 .
③操作①的名称是 .
(3)写出装置II中发生反应的化学方程式 .
(4)请结合化学用语说明装置III中加入磨细的食盐粉及NH3的作用.
(5)该流程中可循环利用的物质是
(6)制出的纯碱中含有杂质NaCl,为测定其纯度,下列方案中不可行的是 . a.向m克纯碱样品中加入足量CaCl2溶液,测生成CaCO3的质量
b.向m克纯碱样品中加入足量稀H2SO4 , 干燥后测生成气体的体积
c.向m克纯碱样品中加入足量AgNO3溶液,测生成沉淀的质量.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】表为元素周期表的一部分:
IA | IIA | IIIA | IVA | VA | VIA | VIIA | ||
二 | C | N | ① | |||||
三 | ② | ③ | ④ | P | ⑤ | ⑥ |
请填写下列空白:
(1)表中元素,原子半径最大的是(填写元素符号);①的核外电子排布式;③和⑥两元素形成化合物的电子式为 .
(2)②③④三种元素最高价氧化物对应的水化物中,碱性最强的是(填化学式).
(3)比较④、⑤两种元素的简单离子半径:>(填离子符号);元素④最高价氧化物对应的水化物与硝酸反应的离子方程式为 .
(4)列举一个事实来证明元素①比元素⑤的非金属性强 .
(5)若8g甲烷气体完全燃烧生成液态水时放出445.15kJ的热量,请写出其热化学方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学实验是进行科学探究、探求新知识的重要途径.某学习小组的同学设计如图装置探究铜片与浓硫酸的反应(加热、夹持装置略去). 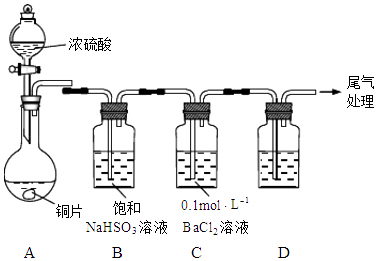
(1)探究I SO2的性质: A中铜片与浓硫酸的反应方程式为: .
(2)实验进行一段时间后,发现C中产生白色沉淀,经检验该沉淀为BaSO4 . 同学甲分析:A中温度过高,产生副产物SO3 , SO3进入C中与BaCl2反应生成BaSO4 . 你认为甲的分析合理吗?请说明理由. .
(3)若用装置D检验SO2的漂白性,则D中溶液是;处理尾气可用 . (填试剂名称)
(4)探究II 关于浓硫酸: 为测定浓硫酸的浓度,同学乙设计如下方案:
取适量该浓硫酸,稀释10倍后取出20mL置于锥形瓶中,滴入2滴酚酞作指示剂,用标准NaOH溶液进行滴定.如果装标准液的滴定管未用标准液润洗,会导致测定结果;如果锥形瓶用待测液润洗,会导致测定结果 . (填“偏高”、“偏低”或“不受影响”)
(5)为测定A中参加反应的硫酸的物质的量,同学丙设计如下方案: 待A中铜片完全溶解,冷却后将溶液稀释至500mL,再加入过量铁粉,使之充分反应,生成的气体在标况下的体积为16.8L;过滤得到残留固体,经洗涤、干燥、称量,比原铁粉质量减轻了35.6g.则A中参加反应的硫酸为mol.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com