
A、J是日常生活中常见的两种金属,这两种金属和NaOH组成原电池,A作负极;F常温下是气体单质,各物质有以下的转化关系(部分产物及条件略去)。
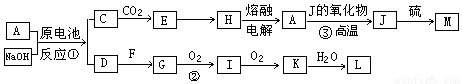
请回答以下问题:
(1)写出该原电池的总反应方程式_____________________。
(2)写出②的化学方程_________________。
(3)常温时pH=12的C溶液中,溶质的阳离子与溶质的阴离子浓度之差为 。(写出计算式)
(4)若③中J的氧化物为磁性氧化物,且每生成1mol J放出Q kJ的热量,请写出A→J反应的热化学方程式 。
(1)2Al+2NaOH +2H2O=2NaAlO2+ 3H2↑
(2)4NH3+5O2 4NO+6H2O
4NO+6H2O
(3)(10-2–10-12)mol·L-1 ,或c(OH-)–c(H+)
(4)3Fe3O4(S)+8Al(S)=9Fe (S)+4 Al2O3(S) △H=-9Q kJ·mol-1
【解析】由题意知,(1)由题意可推知:A是Al;J是Fe.当这两种金属和NaOH组成原电池,Al作负极,Fe作正极。该原电池的总反应方程式2Al +2NaOH +6H2O=2Na AlO2+ 3 H2↑ C是NaAlO2,D是H2;E是Al(OH)3,H是Al2O3,M是FeS。F是N2,G是NH3,I是NO,K是NO2,L是HNO3。
(2)②的化学方程式为:4NH3+5O2 4NO+6H2O;
4NO+6H2O;
(3)常温时pH=12的C溶液中,C(H+)=1×10-12mol/L,
C(OH-)=Kw/C(H+)=(1×10-14)÷(1×10-12)=1×10-2mol/L。因为溶液呈电中性,所,以C(Na+)+C(H+)=C(AlO2-)+C(OH-),C(Na+)-C(AlO2-)=C(OH-)-C(H+)=(10-2-10-12)mol/L.(4)③中铝与Fe3O4反应的热化学方程式为:3Fe3O4(S)+ 8Al(S) =9Fe (S)+4 Al2O3(S) △H=-9Q kJ·mol-1


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:2014高考名师推荐化学--预测11 题型:推断题
A、B、C、D四种物质溶于水均完全电离,电离出的离子如下表。
阳离子 | Na+、Al3+、Ba2+、H+、NH4+ |
阴离子 | SO42-、OH-、CO32-、Cl- |
现进行如下实验:
①足量A溶液与B溶液混合共热可生成沉淀甲和刺激性气味气体;
②少量A溶液与C溶液混合可生成沉淀乙;
③A溶液与B溶液均可溶解沉淀乙,但都不能溶解沉淀甲。
请回答:
(1)A的化学式为_________;室温时,将pH相等的A溶液与D溶液分别稀释10倍,pH分别变为a和b,则a _______b(填“>”、“=”或“<”)。
(2)加热蒸干C溶液并灼烧,最后所得固体为_______(填化学式)。
(3)C溶液与D溶液反应的离子方程式为_______。
(4)向B溶液中逐滴加入等体积、等物质的量浓度的NaOH溶液,滴加过程中水的电离平衡将_______(填“正向”、“不”或“逆向”)移动;最终所得溶液中各离子浓度由大到小的顺序为__________________。
(5)已知沉淀甲的Ksp=x。将0.03mol·L-1的A溶液与0.01mol·L-1的B溶液等体积混合,混合溶液中酸根离子的浓度为_______ (用含x的代数式表示,混合后溶液体积变化忽略不计)。
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测1 题型:简答题
图①-?分别代表有关反应中的一种物质,请填下以下空白。
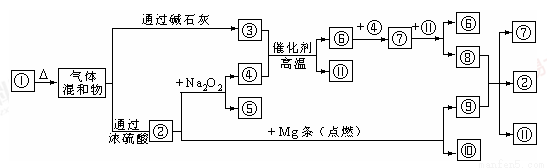
(1)①、④的化学式分别是______、______。
(2)用电子式表示②的形成过程为 ;
(3)⑧与⑨反应的化学方程式是______;检验③的存在的方法是 。
(4)Mg也可以与⑧的稀溶液反应生成⑥,写出反应的离子方程式 。
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测 题型:选择题
室温时,下列各组离子在指定溶液中可以大量共存的是
A.由水电离出的c(H+)=10-12mol/L的溶液中:Na+、Ba2+、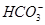 、Cl-
、Cl-
B.无色透明溶液中:K+、Cu2+、SO42-、Na+
C.含有大量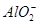 的溶液中:Na+、OH-、Cl-、
的溶液中:Na+、OH-、Cl-、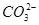
D.能使pH试纸显红色的溶液中:Na+、ClO-、Fe2+、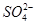
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测 题型:选择题
下列关于有机物叙述不正确的是
A.甲烷制备四氯化碳发生取代反应,四氯化碳可萃取碘水中的碘
B.煤通过干馏,可以将煤中含有的苯、甲苯、二甲苯等芳香烃从煤中分离出来
C. 淀粉、纤维素最终均可以水解生成葡萄糖
D.氯乙烯、苯分子内所有原子均在同一平面中
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--线索综合3 题型:简答题
二甲醚(CH3OCH3)是一种重要的清洁燃料气,其储运、燃烧安全性、理论燃烧温度等性能指标均优于液化石油气,也可用作燃烧电池的燃料,具有很好的好展前景。
(1)已知H2、CO和CH3OCH3的燃烧热(ΔH)分别为-285.5kJ/mol、-283kJ/mol和-1460.0 kJ/mol,则工业上利用水煤气成分按1:1合成二甲醚的热化学方程式为: 。
(2)工业上采用电浮远凝聚法处理污水时,保持污水的pH在5.0,通过电解生成Fe(OH)3胶体,吸附不溶性杂质,同时利用阴极产生的H2,将悬浮物带到水面,利于除去。实验室以二甲醚燃料电池模拟该方法设计的装置如下图所示:
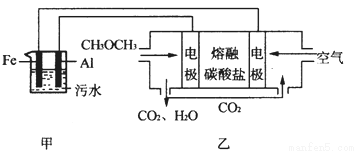
①乙装置以熔融碳酸盐为电解质,稀土金属材料为电极。写出该燃料电池的正极电极反应式 ;下列物质可用做电池熔融碳酸盐的是 。
A.MgCO3 B.Na2CO3 C.NaHCO3 D.(NH4)2CO3
②写出甲装置中阳极产物离子生成Fe(OH)3沉淀的离子方程式 。
③已知常温下Ksp[Fe(OH)3]=4.0×10-38,电解一段时间后,甲装置中c(Fe3+)= 。
④已知:H2S的电离平衡常数:K1=9.1×10-8、K2=1.1×10-12;H2CO3的电离平衡常数:K1=4.31×10-7、K2=5.61×10-11。测得电极上转移电子为0.24mol时,将乙装置中生成的CO2通入200mL 0.2mol/L的Na2S溶液中,下列选项正确的是
A.发生反应的离子方程式为:CO2+S2-+H2O=CO32-+H2S
B.发生反应的离子方程式为:CO2+S2-+H2O=HCO3-+HS-
C.c(Na+)=2[c(H2S)+c(HS-)+c(S2-)]
D.c(Na+)+c(H+)=2c(CO32-)+2c(S2-)+c(OH-)
E.c(Na+)>c(HCO3-)>c(HS-)>c(OH-)
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--线索综合1 题型:简答题
A、B、C、D为原子序数依次增大的四种短周期元素,其性质或结构 信息如下表:
信息如下表:

试回答以下问题
(1)B在周期表中的位置是 。B的氢化物与E的氢化物比较,沸点较高的是 (填化学式),在水中溶解度较大的是 (填化学式)
(2)写出D3B与甲反应所得溶液呈 (填“酸性”、“碱性”或“中性”),原因是(用化学方程式表示) 。
(3)写出丙的电子式为 。说明丙的水溶液在放置过程中其酸性会增强的原因(用离子方程式表示) 。
(4)由A、B、C、D四种元素中的三种元素组成的一种盐丁,其外观与氯化钠相似,丁的水溶液呈碱性。可用来鉴别丁和氯化钠的试剂有
A.氢碘酸和淀粉的混合液 B.AgNO3溶液
C.甲基橙试剂 D.稀硫酸
(5)将光亮的铜丝插入丁溶液中,没有现象发生,如用盐酸酸化,反应迅速发生,铜丝缓慢溶解生成深绿色溶液,写出该反应的离子方程式 。
查看答案和解析>>
科目:高中化学 来源:2014福建安溪一中、养正中学、惠安一中高一下学期期末化学试卷(解析版) 题型:选择题
已知断裂1 mol C—H键,要吸收热量414.4 kJ;断裂1 mol C—C键,要吸收热量347.4 kJ;生成1 mol C===C键,会放出热量615.3 kJ;生成1 mol H—H键,会放出热量435.3 kJ,某有机物分解的反应可表示为:
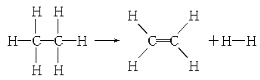
若在反应中消耗了1 mol乙烷(反应物),则有关该反应的说法正确的是( )
A.该反应放出251.2 kJ的热量 B.该反应吸收251.2 kJ的热量
C.该反应放出125.6 kJ的热量 D.该反应吸收125.6 kJ的热量
查看答案和解析>>
科目:高中化学 来源:2014年高考化学鲁科版4.3铜及其化合物 金属材料与复合材料练习卷(解析版) 题型:选择题
硝酸铜是一种重要的工业产品,化学上有很多方法可以制取硝酸铜:①将铜溶于硝酸中、②先将铜与O2反应生成CuO,再溶于硝酸中、③将铜溶于N2O4的乙酸乙酯(溶剂,不参加反应)溶液中生成硝酸铜和一氧化氮。下列认识或判断错误的是( )。
A.方法③是最经济和环保的
B.方法①中,若从经济和环保的角度考虑,用稀硝酸比用浓硝酸好
C.方法②需要消耗能源,对环境不产生污染
D.方法③中N2O4既是氧化剂又是还原剂
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com