
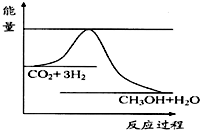
 由于温室效应和资源短缺等问题,如何降低大气中的CO2含量并加以开发利用,引起了各国的普遍重视.目前工业上有一种方法是用CO2生产燃料甲醇.一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),如图表示该反应进行过程中能量(单位为kJ•mol-1)的变化.
由于温室效应和资源短缺等问题,如何降低大气中的CO2含量并加以开发利用,引起了各国的普遍重视.目前工业上有一种方法是用CO2生产燃料甲醇.一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),如图表示该反应进行过程中能量(单位为kJ•mol-1)的变化.分析 (1)图象可知反应物能量高于生成物,反应为放热反应,反应熵变△S<0,依据反应自发进行的判断依据,△H-T△S<0分析温度;
(2)平衡常数K=$\frac{生成物平衡浓度幂次方乘积}{反应物平衡浓度幂次方乘积}$;
(3)反应是放热反应,温度降低平衡正向进行;
(4)若为两个容积相同的密闭容器,现向甲容器中充入1mol CO2(g)和3molH2(g),乙容器中充入1mol CH3OH(g)和1mol H2O(g),在相同
的温度下进行反应,达到相同平衡;
(5)依据热化学方程式和盖斯定律计算得到CH3OH燃烧生成CO2和水蒸气的热化学方程式;
解答 解:(1)CO2(g)+3H2(g)?CH3OH(g)+H2O(g),图象可知反应物能量高于生成物,反应为放热反应,反应熵变△S<0,依据反应自发进行的判断依据,△H-T△S<0分析温度在较低温下蒸发进行,
故答案为:小于,较低;
(2)CO2(g)+3H2(g)?CH3OH(g)+H2O(g),平衡常数K=$\frac{生成物平衡浓度幂次方乘积}{反应物平衡浓度幂次方乘积}$=$\frac{c(C{H}_{3}OH)c({H}_{2}O)}{c(C{O}_{2}){c}^{3}({H}_{2})}$,
故答案为:$\frac{c(C{H}_{3}OH)c({H}_{2}O)}{c(C{O}_{2}){c}^{3}({H}_{2})}$;
(3)CO2(g)+3H2(g)?CH3OH(g)+H2O(g),△H<0,反应是放热反应,降低温度平衡正向进行,平衡常数增大,
故答案为:增大;
(4)若为两个容积相同的密闭容器,现向甲容器中充入1mol CO2(g)和3molH2(g),乙容器中充入1mol CH3OH(g)和1mol H2O(g),相当于加入1mol CO2(g)和3molH2(g),在相同的温度下进行反应,达到相同平衡,甲容器内n(CH3OH)等于乙容器内n(CH3OH),
故答案为:等于;
(5)①CO(g)+2H2(g)=CH3OH (g)△H=-116kJ•mol-1;
②CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H=-283kJ•mol-1;
③H2 (g)+$\frac{1}{2}$O2(g)=H2O(g)△H=-242kJ•mol-1;
依据盖斯定律计算(③×2+②-①)×2CH3OH燃烧生成CO2和水蒸气的热化学方程式2CH3OH(g)+3O2(g)═2CO2(g)+4H2O(g)△H=-1302kJ/mol,
故答案为:2CH3OH(g)+3O2(g)═2CO2(g)+4H2O(g)△H=-1302kJ/mol;
点评 本题考查了影响反应速率的因素、化学平衡状态的判断、热化学方程式书写,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 新制饱和氯水中:Na+、Al3+、SO32-、SO42- | |
| B. | 加入铝粉能产生氢气的溶液中:NH4+、Fe2+、NO3-、SO42- | |
| C. | 常温下,在碱性的溶液中:K+、AlO2-、CO32-、Na+ | |
| D. | 在碱性的溶液中:K+、NH4+、AlO2-、HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在7.8gNa2O2晶体中阳离子与阴离子总数为0.3NA | |
| B. | 在KIO3+6HI=KI+3I2+3H2O反应中,每生成3mol I2,则转移6NA个电子 | |
| C. | 1mol Na2O2与H2O完全反应,转移的电子总数为NA | |
| D. | 在1L0.1mol/L的碳酸钠溶液中,阴离子总数大于0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 无色溶液中:NH4+、Ag+、PO43-、Cl- 能大量共存 | |
| B. | 水电离产生的c(H+)=10-12 mol•L-1的溶液:K+、Ba2+、Cl?、Br-一定能大量共存 | |
| C. | 使紫色石蕊试液变红的溶液:Fe2+、Mg2+、NO3-、Cl-能大量共存 | |
| D. | pH=4.5的番茄汁中c(H+)是pH=6.5的牛奶中c(H+)的2倍 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将AlCl3溶液加热蒸干可得无水AlCl3 | |
| B. | 用25ml碱式滴定管量出14.80ml的碳酸钠溶液 | |
| C. | 在中和滴定的实验过程中,目光只应注视滴定管的液面 | |
| D. | 用蒸馏水湿润过的pH试纸测0.1mol/L的醋酸溶液的pH值 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 22.4 LCl2分别与铁和铜反应时,失电子数目均为NA | |
| B. | 1mol Na2O2与CO2足量反应时,转移NA个电子 | |
| C. | 12.0gNaHSO4固体中含有的阳离子数目为0.2NA | |
| D. | 1mol Na2O2晶体中含有的阴离子数目为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将分别蘸有浓硝酸和浓氨水的玻璃棒相互靠近时,有白烟生成 | |
| B. | 硝酸具有酸的通性,如果与活泼金属反应,会有H2生成 | |
| C. | 浓硝酸能使活泼金属如铝、镁、锌、铁等发生“钝化” | |
| D. | 常温下,铜与稀HNO3反应很慢,是因为发生了“钝化” |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
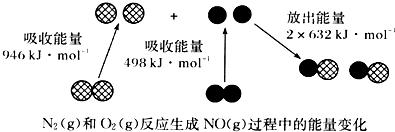
| A. | 1molN2(g)和NA个O2(g)反应放出的能量为180 kJ | |
| B. | 1molN2(g)和1molO2(g)具有总能量小于2molNO(g)具有的总能量 | |
| C. | 通常情况下,N2(g)和O2(g)混合能直接生成NO | |
| D. | 吸热反应一定需要加热才能发生 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 现象 | 结论 |
| A | 向KBr溶液中加入CCl4和氯水 | CCl4层呈红色 | 氧化性:Cl2>Br2 |
| B | 向难溶的PbSO4加入CH3COONH4溶液 | 得到无色溶液 | (CH3COO)2Pb是弱电解质 |
| C | 向KNO3和KOH的混合溶液中加入Al,微热,关口放湿润的红色石蕊试剂 | 试剂变为蓝色 | NO3-被还原为NH3 |
| D | 高温加热炭粉于Fe2O3的混合物 | 产物能被磁铁吸引 | 产物中含有Fe或Fe3O4中的一种或两种 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com