
����Ŀ����ҵ�ϣ���500��600�����м��ͨ������������ˮ�Ȼ������������м��ͨ���Ȼ���������ˮ�Ȼ�������������ͼ��ʾ��װ��ģ���������̽������飮�ش��������⣺ 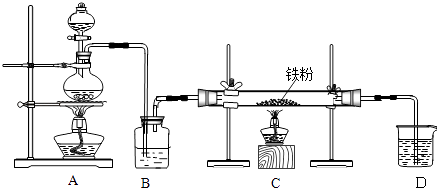
��1����ȡ��ˮ�Ȼ�����ʵ���У�A�з�Ӧ�Ļ�ѧ����ʽΪ �� װ��B�м�����Լ��� ��
��2����ȡ��ˮ�Ȼ�������ʵ���У�װ��A������ȡ �� β���ijɷ��� �� ������D��װ�ý���β�����������ڵ��������� ��
��3���������������Ƶõ�FeCl2 �Ậ������FeCl3 �� ����FeCl3���õ��Լ��� �� ���Ƶô�����FeCl2 �� ��ʵ�������Ӧ�ȵ�ȼ���ľƾ��ƣ�Ŀ���� ��
���𰸡�
��1��MnO2+4HCl��Ũ�� ![]() ?MnCl2+Cl2��+2H2O��Ũ����
?MnCl2+Cl2��+2H2O��Ũ����
��2��HCl��HCl��H2��������������ȼ������H2���ܱ�����
��3��KSCN��Һ��A���ų�װ���еĿ�������ֹ�ڼ���ʱFe��O2��Ӧ
���������⣺��1����ȡ��ˮ�Ȼ�����ʵ���У�Aװ����ȡ����������ʵ���ҳ���Ũ������������̼�����ȡ����ѧ��Ӧ����ʽΪ��MnO2+4HCl��Ũ�� ![]() MnCl2+Cl2��+2H2O����ȡ�������к���ˮ������װ��B�������Ǹ�������������Ũ���ᣬ���Դ��ǣ�MnO2+4HCl��Ũ��
MnCl2+Cl2��+2H2O����ȡ�������к���ˮ������װ��B�������Ǹ�������������Ũ���ᣬ���Դ��ǣ�MnO2+4HCl��Ũ�� ![]() MnCl2+Cl2��+2H2O��Ũ�����2����ȡ��ˮ�Ȼ���������ҪHCl���壬��Aװ����ȡ����HCl����Ӧ����ʽΪ��Fe+2HCl
MnCl2+Cl2��+2H2O��Ũ�����2����ȡ��ˮ�Ȼ���������ҪHCl���壬��Aװ����ȡ����HCl����Ӧ����ʽΪ��Fe+2HCl ![]() FeCl2+H2 �� ��β���ijɷ�Ϊδ��Ӧ��HCl�����ɵ�����������HCl��������ˮ��������Ȼ����Dװ�ý���β����������������ɵ�����������������ˮ�����������������գ�������ȼ����ɰ�ȫ���������Դ��ǣ�HCl��HCl��H2��������������ȼ������H2���ܱ����գ���3�������Ȼ����������軯����Һ����Ҫ��ȡ������FeCl2 �� �����ž�װ���еĿ�������ֹ�ڼ���ʱFe��O2��Ӧ�����ȵ�ȼA���ľƾ��ƣ��ٵ�ȼC���ľƾ��ƣ����Դ��ǣ�KSCN��Һ��A���ų�װ���еĿ�������ֹ�ڼ���ʱFe��O2��Ӧ��
FeCl2+H2 �� ��β���ijɷ�Ϊδ��Ӧ��HCl�����ɵ�����������HCl��������ˮ��������Ȼ����Dװ�ý���β����������������ɵ�����������������ˮ�����������������գ�������ȼ����ɰ�ȫ���������Դ��ǣ�HCl��HCl��H2��������������ȼ������H2���ܱ����գ���3�������Ȼ����������軯����Һ����Ҫ��ȡ������FeCl2 �� �����ž�װ���еĿ�������ֹ�ڼ���ʱFe��O2��Ӧ�����ȵ�ȼA���ľƾ��ƣ��ٵ�ȼC���ľƾ��ƣ����Դ��ǣ�KSCN��Һ��A���ų�װ���еĿ�������ֹ�ڼ���ʱFe��O2��Ӧ��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Ԫ��Q��R��T��W��Ԫ�����ڱ��е�λ����ͼ��ʾ,����T��������������������������ȡ�

�ش���������:
��1��T��ԭ�ӽṹʾ��ͼΪ____��
��2��RԪ�ص�����Ϊ____
��3��Ԫ��W�����ڱ��е�λ����____________
��4��W�ĵ�����������������Ӧ��ˮ�����Ũ��Һ�����ܷ�����Ӧ,������������,����һ��������,������Ӧ�Ļ�ѧ����ʽΪ__________��
��5��ԭ��������R��1��Ԫ�ص�һ���⻯���ֽܷ�Ϊ������һ���⻯��,�˷ֽⷴӦ�Ļ�ѧ����ʽΪ____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ͼ�ӡˢ��·����һ�ֵ��ӷ��������ͭ�ĺ����ﵽ��ʯ�еļ�ʮ����ʪ�������ǽ������ӡˢ��·�徭�ܽ⡢��ȡ�����Ȳ����õ���ͭ�Ȳ�Ʒ��ij��ѧС��ģ��÷�������ͭ����ȡ���������̼�ͼ���£�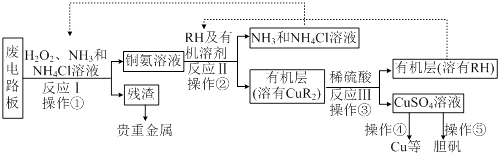
�ش��������⣺
��1����Ӧ���ǽ�Cuת��ΪCu��NH3��2+4����Ӧ��H2O2 �������� ��
��2����ӦII��ͭ����Һ�е�Cu��NH3��2+4���л���RH��Ӧ��д���÷�Ӧ�����ӷ���ʽ�� �� �������õ�����Ҫ��������Ϊ �� ��Ŀ���ǣ�����ţ� ��
a������ͭԪ�� b��ʹͭԪ����ˮ��Һ�е����ʷ��� c������Cu2+��ˮ�е��ܽ��
��3����������ʯī���缫���CuSO4 ��Һ����������ͭ������������ �� ������������ͭ��Һ�Ƶ�������Ҫ������ ��
��4��������������ʵ�����Լ���ѭ��ʹ�ã��������߱�����������������Լ��� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ǻϳ�ũҩ����Ҫ�м��壬��ϳ�·�����£�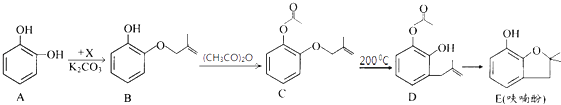
��1��A���ʺ˴Ź������������壬B��C�ķ�Ӧ������ ��
��2����֪x�ķ���ʽΪC4H7C1��д��A��B�Ļ�ѧ����ʽ�� ��
��3��Y��X��ͬ���칹�壬��������֧���Ҳ���������Y�����ƣ�ϵͳ�������� ��
��4�������йػ�����C��D��˵����ȷ���� �� �ٿ����Ȼ�����Һ����C��D
��C��D���еĹ�������ȫ��ͬ
��C��D��Ϊͬ���칹��
��C��D����ʹ��ˮ��ɫ
��5��E��ͬ���칹��ܶ࣬д��һ�ַ������������ķ�����ͬ���칹��Ľṹ��ʽ�� �� �ٻ��ϵ�һ�ȴ���ֻ��һ�� �ں������� ���ܷ���������Ӧ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��H2O2�dz��õ���ɫ��������H2S�ǻ�ԭ������H2S��Ի��������彡����������Σ����
I.H2S�ij�ȥ��������H2S��ԭ��Ϊ:H2S+Fe2(SO4)3=S��+2FeSO4+H2SO4��4FeSO4+O2+2H2SO4![]() 2Fe2(SO4)3+2H2O��
2Fe2(SO4)3+2H2O��
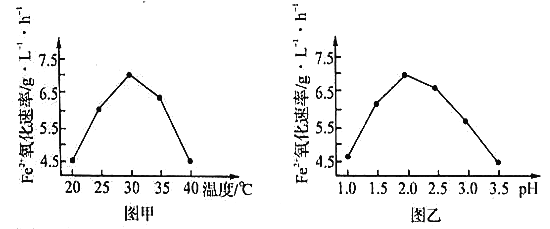
(1)��˾�����ʱ,FeSO4����������������ʱ��5��105�����þ���������_____��
(2)��ͼ��ͼ���ж�������˾����������Ϊ_______������������£��÷�Ӧ�ļ��ȷ�ʽΪ_________������Ӧ�¶ȹ��ߣ���Ӧ�����½�����ԭ����__________��
II.Ϊ�о������������Թ�������ֽ����ʵ�Ӱ�죬ijͬѧ���������һϵ�е�ʵ�顣��������������Һ�ֱ����A��B��C��D�ĸ���Ӧƿ�У��ռ����������壬�ڹ���������:
ʵ����Һ | A/mL | B/mL | C/mL | D/mL |
0.4mol/LFe2(SO4)3��Һ | 0 | 1.0 | 2.0 | V1 |
30%H2O2��Һ | V2 | 20.0 | 20.0 | 20.0 |
H2O | 18.0 | 17.0 | V3 | 15.0 |
(1)ʵ����������¼��������___________��
(2)�ϱ��е�V2=_______��V3=_________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з����ܼ��������Ϳ�������
A. ����ζ B. ������ƿ������ˮ��
C. �۲���ɫ D. �������ǵ�ľ�����뼯��ƿ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ֻ�����W��X��Y��Z�����Ƕ����ɶ�����Ԫ��A��B��C��D��E�е�����Ԫ����ɵģ���֪�� ��a��A��B��C��D��E����Ԫ�ص�ԭ����������������A��Dͬ���壬C��Eͬ���壬B��Cͬ���ڣ�
��b��W��B��C��ɣ�������ԭ�Ӹ�����ΪB��C=1��2��������������
��c��X��A��C��ɣ�������ԭ�Ӹ�����ΪA��C=1��1��
��d��Y��C��D�γɵ����ӻ������Y����ӦԪ�ص���֮��Ϊ��C��D=1��1��
��e��Z����D��E�γɵ����ӻ�������������ӱ���������һ�����Ӳ㣬������������֮��Ϊ1��2��
�Իش����и�С�⣺
��1����Ԫ�ط��ţ�ABCDE
��2��W�ĵ���ʽ�� ��
��3��X�Ľṹʽ�� ��
��4��Y�ĵ���ʽ�� ��
��5��Z�Ļ�ѧʽ�� ��
��6��д��Y��ˮ��Ӧ�Ļ�ѧ����ʽ�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ݸ�����ѧ�Ļ�ѧ��Ӧԭ�������������⣺
��1������ΪCO2������ȡ��̼��������ѧ���ݣ�
��Ӧ��CO2��g��+3H2��g��CH3OH��g��+H2O��g����H=��49.0 kJmol��1
��Ӧ��2CO2��g��+6H2��g��CH3CH2OH��g��+3H2O��g����H=��173.6kJmol��1
д����CH3OH��g���ϳ�CH3CH2OH��g�����Ȼ�ѧ��Ӧ����ʽ��
��2����ҵ�ϳɼ״��ķ�Ӧ��CO��g��+2H2��g��CH3OH��g����H��0��
�ٸ÷�Ӧ�ڲ�ͬ�¶��µĻ�ѧƽ�ⳣ����K�����±���
�¶�/�� | 250 | 350 |
K | 2.041 | x |
���ϱ��е�ƽ�ⳣ��x����ֵ��������ĸ��ţ���
A.0 B.0.012
C.32.081 D.100
����װ����Ϊ�ݻ��̶����ܱ���������ͬʱ��θ����ʵ�Ũ�����±���
c��CO�� | c��H2�� | c��CH3OH�� | |
0min | 0.8molL��1 | 1.6molL��1 | 0 |
2min | 0.6molL��1 | y | 0.2molL��1 |
4min | 0.3molL��1 | 0.6molL��1 | 0.5molL��1 |
6min | 0.3molL��1 | 0.6molL��1 | 0.5molL��1 |
��Ӧ��2min��4min֮�䣬H2��ƽ����Ӧ����Ϊ �� ��Ӧ�ﵽƽ��ʱCO��ת����Ϊ �� ��Ӧ�ڵ�2minʱ�ı��˷�Ӧ�������ı������������������ĸ��ţ���
A��ʹ�ô��� B�������¶� C������H2��Ũ�� D�������¶�
��3��ȫ��Һ�����ܵ�أ�VRB���㷺Ӧ���ڷ��ܡ�̫���ܷ���ϵͳ�Ĵ���ϵͳ����ط�ӦΪVO2++V2++2H+ ![]() VO2++V3++H2O������д���ŵ�ʱ�����ĵ缫��Ӧʽ ��
VO2++V3++H2O������д���ŵ�ʱ�����ĵ缫��Ӧʽ ��
��4����ͼ2Ϊij�¶��£�Fe��OH��3��s����Mg��OH��2��s���ֱ�����Һ�дﵽ�����ܽ�ƽ��ı���Һ��pH������������Ũ�ȱ仯�������ͼ���������¶��£��ܶȻ������Ĺ�ϵΪ��Ksp[Fe��OH��3] Ksp[Mg��OH��2]�������=������������������ɵ�Mg��OH��2��Һ�е���������Fe3+ �� ��ɫ������ȫ��ת��Ϊ���ɫ������ԭ���� �� 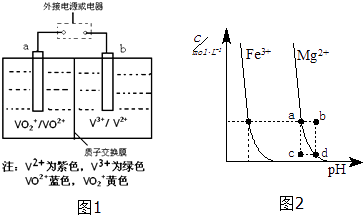
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Ԫ��X��Y��Z��W��R�Ļ��ϼ���ԭ�������Ĺ�ϵ��ͼ��ʾ������˵����ȷ���ǣ� �� 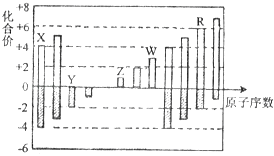
A.ԭ�Ӱ뾶��Z��Y��X
B.��̬�⻯����ȶ��ԣ�Y��R
C.Z��Y�γɵĻ����������ӻ�����
D.�����µ���W������R������������Ӧˮ�����Ũ��Һ
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com