
【题目】下列表示对应化学反应的离子方程式正确的是( )
A. MnO2固体与浓盐酸反应制取Cl2:MnO2+4HCl![]() Mn2++2Cl-+Cl2↑+2H2O
Mn2++2Cl-+Cl2↑+2H2O
B. AlCl3溶液中滴加浓氨水至过量:Al3++4NH3·H2O=AlO2-+4NH4++2H2O
C. Fe2O3溶于过量氢碘酸溶液中:Fe2O3+6H++2I-=2Fe2++I2+3H2O
D. 向次氯酸钠溶液中通入足量SO2气体:ClO-+SO2+H2O=HClO+HSO3-
 名师金手指领衔课时系列答案
名师金手指领衔课时系列答案科目:高中化学 来源: 题型:
【题目】将过量SO2通入下列溶液中,能出现白色浑浊的是( )。
①Ca(OH)2 ②BaCl2 ③NaAlO2 ④Na2SiO3 ⑤Ba(NO3)2 ⑥苯酚钠 ⑦Na2CO3
A. ①②④⑦ B. ②③⑥⑦ C. ④⑤⑥⑦ D. ③④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中,一定条件下,进行如下反应:NO(g)+CO(g)![]() 1/2N2(g)+CO2(g)ΔH=-373.2 kJ/mol,达到平衡后,为提高该反应的速率和CO的转化率,采取的正确措施是( )
1/2N2(g)+CO2(g)ΔH=-373.2 kJ/mol,达到平衡后,为提高该反应的速率和CO的转化率,采取的正确措施是( )
A.加催化剂同时升高温度
B. 升高温度同时充入N2
C.加催化剂同时增大压强
D.降低温度同时减小压强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是可逆反应A+2B![]() 2C+3D的化学反应速率与化学平衡随外界条件改变(先降温后加压)而变化的情况。由此可推断下列结论错误的是( )
2C+3D的化学反应速率与化学平衡随外界条件改变(先降温后加压)而变化的情况。由此可推断下列结论错误的是( )
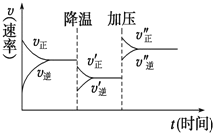
A.正反应是放热反应B.A、B一定都是气体
C.D一定不是气体D.C可能是气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I、为了研究化学反应A+B=C+D的能量变化情况,某同学设计了如图所示装置。当向盛有A的试管中滴加试剂B时,看到U形管中甲处液面下降乙处液面上升。试回答下列问题:
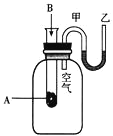
(1)该反应为________反应(填“放热”或“吸热”)。
(2)A和B的总能量比C和D的总能量_________(填“高”或“低”)。
(3)该反应的物质中的化学能通过化学反应转化成________释放出来。
(4)该反应的反应物化学键断裂吸收的能量________(填“高”或“低”)于生成物化学键形成放出的能量。
(5)Ⅱ、同素异形体相互转化的反应热相当小,而且转化速率较慢,有时还很不完全,测定反应热很困难。现在可根据盖斯提出的“不管化学过程是一步完成还是分几步完成,这个总过程的热效应是相同的”观点来计算反应热。
已知:
①P4(白磷,s)+5O2(g)= P4O10(s) ΔH=-2983.2 kJ·mol1
②P(红磷,s)+5/4O2(g)=1/4P4O10(s) ΔH=-738.5 kJ·mol1
则白磷转化为红磷的热化学方程式为__________。相同状况下,能量状态较低的是________;白磷的稳定性比红磷_________(填“高”或“低”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙醇是制取饮料、香精、染料、涂料、洗涤剂等产品的原料.
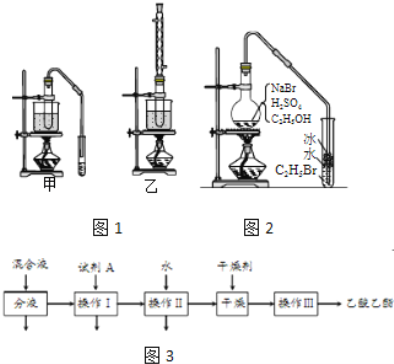
完成下列填空:
(1)实验室用乙醇制取乙烯时,浓硫酸的用量远远超过作为催化剂的正常用量,原因是______.
(2)验证乙烯加成反应性质时,需对乙烯气体中的干扰物质进行处理,可选用的试剂是______(填写化学式);能确定乙烯通入溴水中发生了加成反应的事实是______.(选填编号)
a.溴水褪色 b.有油状物质生成
c.反应后水溶液酸性增强 d.反应后水溶液接近中性
(3)实验室用乙醇和乙酸制备乙酸乙酯时,甲乙两套装置如图1都可以选用.关于这两套装置的说法正确的是______.(选填编号)
物质 | 沸点(℃) |
乙醇 | 78.5 |
乙酸 | 117.9 |
乙酸乙酯 | 77 |
a.甲装置乙酸转化率高 b.乙装置乙酸转化率高
c.甲装置有冷凝回流措施 d.乙装置有冷凝回流措施
(4)用乙装置实验时,提纯乙中乙酸乙酯的流程如图3,以上流程中试剂A的化学式是______;操作Ⅱ的名称是______;操作Ⅲ一般适用于分离______混合物.
(5)如图2是用乙醇制备溴乙烷的装置,实验中有两种加料方案:
①先加溴化钠→再加乙醇→最后加1:1浓硫酸;
②先加溴化钠→再加1:1浓硫酸→最后加乙醇.
按方案①和②实验时,产物都有明显颜色,若在试管中加入______,产物可变为无色.与方案①相比较,方案②的明显缺点是______.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法错误的是
A. 电解饱和食盐水可制取烧碱、氯气、氢气
B. 从海水中可提取镁、溴、碘等物质
C. 粗铜(含少量Zn、Fe、Pt等)电解精炼后,溶液中金属阳离子只有Fe2+、Zn2+
D. 在镀件上镀铜,镀件作阴极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)1.7g氨气在标准状况下的体积是_____________升,共含有_____________mol电子;0.1mol硫化氢共含有_____________个质子,同质量的氨气和硫化氢气体中分子个数比为_____________,含氢原子的个数比为_____________。在标准状况下硫化氢的密度为_____________。
(2)在标准状况下,18gCO和CO2的混合气体完全燃烧后得到11.2LCO2,则原混合气体的密度是_____________,原混合气体中,CO的质量是_____________,CO2的体积是_____________碳原子和氧原子的个数比为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期表为我们提供了许多关于元素的重要信息,是学习化学和研究化学的重要工具。元素周期表中某个小方格的内容如图所示,下列叙述不正确的是

A.“26”表示该元素原子的相对原子质量
B.“Fe”是该元素的元素符号
C.该元素是一种金属元素
D.该元素的名称是铁
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com