
 用如图所示装置进行实验.实验过程中,两极均有气体产生,Y极区溶液逐渐变成紫红色;停止实验,铁电极明显变细,电解液仍然澄清.
用如图所示装置进行实验.实验过程中,两极均有气体产生,Y极区溶液逐渐变成紫红色;停止实验,铁电极明显变细,电解液仍然澄清.分析 (1)电解过程中,X电极上H+放电生成氢气,电极反应式为2H2O+2e-=H2↑+2OH-,据此回答;
(2)X电极收集的气体是氢气,Y电极析出氧气,根据转移电子相等计算铁溶解的质量.
解答 解:(1)电解过程中,X电极上电极反应式为2H2O+2e-=H2↑+2OH-,所以c(OH-)增大,溶液的pH增大,故答案为:增大;
(2)X电极收集的气体是氢气,n(H2)=$\frac{0.672L}{22.4L/mol}$=0.03mol,Y电极析出氧气的物质的量=$\frac{0.168L}{22.4L/mol}$=0.0075mol,根据转移电子相等得铁溶解的质量=$\frac{0.03mol×2-0.0075mol×4}{6}$×56g/mol=0.28g,故答案为:0.28.
点评 本题考查了电解原理,明确高铁酸钠的制取原理是解本题关键,再结合转移电子相等进行有关计算,难点是电极反应式书写,题目难度中等.


科目:高中化学 来源: 题型:选择题
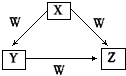 X、Y、Z、W四种物质之间有如图所示的转化关系(部分物质未写全),则X、Y、Z、W可能是( )
X、Y、Z、W四种物质之间有如图所示的转化关系(部分物质未写全),则X、Y、Z、W可能是( )| A. | ①②③ | B. | ①② | C. | ② | D. | ① |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 中和10ml 0.1 mol•L-1醋酸与中和100ml 0.01 mol•L-1醋酸所需同种碱溶液的量不同 | |
| B. | 体积相等、pH相等盐酸和硫酸溶液中,H+离子的物质的量相等 | |
| C. | 等体积pH=3的酸溶液与pH=11的碱溶液相混合后,混合溶液的pH一定等于7 | |
| D. | 250C时,将0.1 mol•L-1NaOH溶液与pH=1的稀硫酸等体积混合,混合后溶液pH=7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
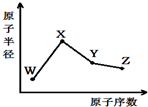
| A. | 最高化合价X>Y>Z>W | |
| B. | 气态氢化物的稳定性Z>Y>W | |
| C. | Y的氧化物与X、Z的最高价氧化物对应的水化物均能反应 | |
| D. | 由X、Z、W三种元素形成的化合物一定既含离子键又含共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 英国科学家安德烈•海姆和康斯坦丁•诺沃肖洛夫因在石墨烯(如图)材料方面的卓越研究而获得2010年诺贝尔物理学奖.六方氮化硼(BN)与石墨是等电子体,它有“白石墨”之称,具有类似石墨的层状结构,有良好的润滑性.C、N、B的第一电离能由大到小的顺序为N>C>B,电负性由小到大的顺序为B<C<N.
英国科学家安德烈•海姆和康斯坦丁•诺沃肖洛夫因在石墨烯(如图)材料方面的卓越研究而获得2010年诺贝尔物理学奖.六方氮化硼(BN)与石墨是等电子体,它有“白石墨”之称,具有类似石墨的层状结构,有良好的润滑性.C、N、B的第一电离能由大到小的顺序为N>C>B,电负性由小到大的顺序为B<C<N.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 化合物 | 甲 | 乙 | 丙 | 丁 |
| 原子个数比 | B:A=1:3 | C:A=1:2 | D:A=1:1 | E:A=1:1 |
| A. | 元素E在元素周期表中的位置为第二周期第ⅦA族 | |
| B. | 原子半径:A<B<C<D | |
| C. | A、C、E中三种元素或任意两种元素形成的物质中只可能含有共价键 | |
| D. | A、B、C、D四元素中的三种能形成多种与甲分子电子数相等的化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③ | B. | ①③ | C. | ①④ | D. | ③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可用氨水除去试管内壁上的银镜 | |
| B. | 用湿润的蓝色石蕊试纸检验氨气 | |
| C. | 硅酸钠溶液应保存在带玻璃塞的试剂瓶中 | |
| D. | 锌与稀硫酸反应时,要加快反应速率可滴加少量硫酸铜 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com