
| A. | O2 | B. | Cl2 | C. | N2 | D. | CO2 |
分析 根据n=$\frac{m}{M}$,结合分子所含电子数分析解答.
解答 解:设气体的质量都为1g,
A、氧气的物质的量为:$\frac{1g}{32g/mol}$,所以含电子数为:$\frac{1g}{32g/mol}$×16=0.5mol;
B、氯气的物质的量为:$\frac{1g}{71g/mol}$,所以含电子数为:$\frac{1g}{71g/mol}$×34=0.49mol;
C、氮气的物质的量为:$\frac{1g}{28g/mol}$,所以含电子数为:$\frac{1g}{28g/mol}$×14=0.5mol;
D、二氧化碳的物质的量为:$\frac{1g}{44g/mol}$,所以含电子数为:$\frac{1g}{44g/mol}$×22=0.5mol;综上电子数最少的是B,故选B.
点评 本题考查物质的量的有关计算,题目难度不大,注意根据物质的量和气体的分子组成计算电子数目的多少.


科目:高中化学 来源: 题型:实验题
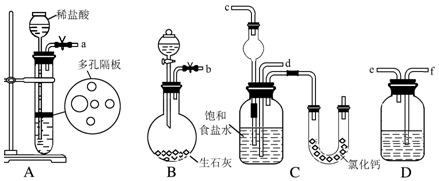
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

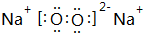 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
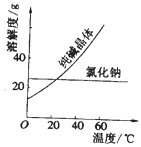
| 物质 | 熔点/℃ | 沸点/℃ | 密度/g•cm-3 | 溶解性 |
| 乙二醇( C2H6O2) | -11.5 | 198 | 1.11 | 易溶于水和乙醇 |
| 丙三醇(C3H8O3) | 17.9 | 290 | 1.26 | 能跟水、酒精以任意比互溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省高一上10月月考化学试卷(解析版) 题型:选择题
以下是对某水溶液进行离子检验的方法和结论,其中正确的是
A.先加入BaCl2溶液,再加入足量HNO3溶液,产生白色沉淀,溶液中一定含有大量SO42-
B.加入足量的CaCl2溶液,产生了白色沉淀。溶液中一定含有大量的CO32-
C.加入足量浓 NaOH溶液,产生带有强烈刺激性气味的气体,溶液中一定含有大量NH4+
D.先加适量盐酸将溶液酸化,再加AgNO3溶液,产生白色沉淀,溶液中一定含有大量Cl-
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省高一上10月月考化学试卷(解析版) 题型:选择题
下列物质中,本身属于非电解质,溶于水与水反应的生成物属于电解质的是 ( )
A.氯化钠 B.氯气 C.三氧化硫 D.乙醇
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验 序号 | 反应温度 (℃) | 参加反应的物质 | ||||
| Na2S2O3 | H2SO4 | H2O | ||||
| V/mL | c/mol•L-1 | V/mL | c/mol•L-1 | V/mL | ||
| A | 20 | 10 | 0.1 | 10 | 0.1 | 0 |
| B | 20 | 5 | 0.1 | 10 | 0.1 | 5 |
| C | 20 | 10 | 0.1 | 5 | 0.1 | 5 |
| D | 40 | 5 | 0.1 | 10 | 0.1 | 5 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com