
分析 (1)CuO是碱性氧化物,能和酸反应生成盐和水;
(2)向氢氧化钡溶液中加入硫酸铜溶液,生成氢氧化铜沉淀和硫酸钡沉淀,据此写出化学方程式和离子方程式;
(3)锌粉和硫酸氢钠的反应,实质是和溶液中的氢离子的反应;
(4)石灰乳即糊状的Ca(OH)2,能和盐酸反应生成氯化钙和水;
(5)碳酸钠和醋酸反应生成醋酸钠和二氧化碳、水,而醋酸是弱酸,不能拆.
解答 解:(1)CuO是碱性氧化物,能和酸反应生成盐和水,化学方程式为:CuO+2HNO3=Cu(NO3)2+H2O,根据能拆的有强酸、强碱和可溶性盐可知,其离子方程式为:CuO+2H+=Cu2++H2O,故答案为:CuO+2H+=Cu2++H2O;
(2)向氢氧化钡溶液中加入硫酸铜溶液,生成氢氧化铜沉淀和硫酸钡沉淀,故化学方程式为:Ba(OH)2+CuSO4=BaSO4↓+Cu(OH)2↓,故离子方程式为:Ba2++2OH-+Cu2++SO42-=BaSO4↓+Cu(OH)2↓,故答案为:Ba2++2OH-+Cu2++SO42-=BaSO4↓+Cu(OH)2↓;
(3)锌粉和硫酸氢钠的反应,实质是和溶液中的氢离子的反应,故离子方程式为:Zn+2H+=Zn2++H2↑,故答案为:Zn+2H+=Zn2++H2↑;
(4)石灰乳即糊状的Ca(OH)2,能和盐酸反应生成氯化钙和水,而石灰乳不能拆,故离子方程式为:Ca(OH)2+2H+=Ca2++2H2O,故答案为:Ca(OH)2+2H+=Ca2++2H2O;
(5)碳酸钠和醋酸反应生成醋酸钠和二氧化碳、水,而醋酸是弱酸,不能拆,故离子方程式为:CO32-+2CH3COOH=2CH3COO-+H2O+CO2↑,故答案为:CO32-+2CH3COOH=2CH3COO-+H2O+CO2↑;
点评 本题考查了常见的离子方程式的书写,难度不大,应注意的是在书写离子方程式时,能拆的只有强酸、强碱和可溶性盐,其余均不能拆,注意基础的掌握.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
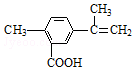
| A. | 在一定条件下,能发生取代、氧化、水解、酯化和加聚反应 | |
| B. | 该物质分子中最多可以有9个碳原子在同一平面上 | |
| C. | 1 mol该物质最多可与5mol H2发生加成反应 | |
| D. | 1 mol该物质完全氧化最多可消耗13 mol氧气 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电池工作时,溶液中的铝离子向正极移动 | |
| B. | 该电池可能是一种可充电的二次电池 | |
| C. | 消耗相同质量金属时,用锂做负极时,产生电子的物质的量比铝多 | |
| D. | 该电池负极的电极反应为:Al-3e-═Al3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cu(OH)2+HC1; Cu(OH)2+CH3COOH | B. | NaHCO3+H2SO4;Na2CO3+HCl | ||
| C. | NaHS04+NaOH; H2SO4+NaOH | D. | BaCl2与 Na2SO4;Ba(OH)2 与 CuSO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)反应3A(g)+B(g)═2C(g)在三种不同的条件下进行反应,在同一时间内,测得的反应速率用不同的物质表示为①vA=1 mol/(L•min)、②vC=0.5mol/(L•min)、③vB=0.5mol/(L•min),三种情况下该反应速率由大到小的关系是③>①>②.(用序号表示)
(1)反应3A(g)+B(g)═2C(g)在三种不同的条件下进行反应,在同一时间内,测得的反应速率用不同的物质表示为①vA=1 mol/(L•min)、②vC=0.5mol/(L•min)、③vB=0.5mol/(L•min),三种情况下该反应速率由大到小的关系是③>①>②.(用序号表示)查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 三种溶液的pH的大小顺序是①>②>③ | |
| B. | 三种溶液稀释相同倍数,pH变化最大的是① | |
| C. | 三种溶液中含微粒种类多少顺序是:②>①>③ | |
| D. | 三种溶液中由水电离出c(H+)大小顺序是:③>②>① |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com