
【题目】下列变化中,必须加入还原剂才能实现的是( )
A.NaCl→AgCl
B.H2O→O2
C.KClO3→KCl
D.MnO2→MnCl2
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,根据所给的10 种元素,回答下列间题.
族 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
2 | C | N | F | Na | ||||
3 | Na | Mg | Al | Si | S | Cl |
(1)非金属性最强的元素是;
(2)Ne 原子结构示意图为;
(3)C 与N 中,原子半径较小的是;
(4)氯水具有漂白作用,是由于其中含有(填“HCl”或“HClO”)
(5)元素最高价氧化物对应的水化物中,碱性最强的是(填化学式),呈两性的是(填化学式);
(6)元素硅的氧化物常用于制造(填一种高性能的现代通讯材料的名称);
(7)如图为某有机物的球棍模型(其中 ![]() 代表氢原子代表
代表氢原子代表 ![]() 碳原子),
碳原子), 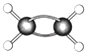 该有机物中碳元素与氢元素的质量比m(C):m(H)= . (相对原子质量C﹣12、H﹣1)
该有机物中碳元素与氢元素的质量比m(C):m(H)= . (相对原子质量C﹣12、H﹣1)
(8)镁是制造汽车、飞机、火箭的重要材料.写出工业上电解熔融氯化镁获得金属镁的化学方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铋是一种绿色稀有金属,铋及其化合物在工业生产中用途广泛,工业上常采用粗铋精炼制得用途更为广泛的精炼铋(含铋99.995%),火法精炼铋的工艺流程如下:
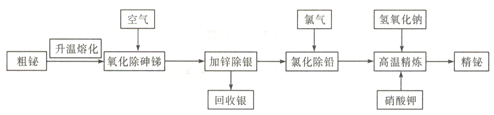
已知:①粗铋(铅铋合金)的主要化学成分如下表:
元素 | Ag | Bi | Pb | As | Sb |
含量/% | 0.90 | 55.25 | 27 | 1.30 | 11 |
②氯化铅熔点为498℃,密度为5.9g/cm3;铋的熔点为271℃,沸点为1470℃;BiCl3的熔点为506.5℃。
③锌酸盐简写成ZnO22-,如锌酸钠Na2ZnO2。
④+3价铋的化合物较为稳定,铋酸钠难溶于水。
回答下列问题:
(1)实验室中升温熔化粗铋一般用酒精喷灯在________(填主要仪器名称)中完成。
(2)NaBiO3中铋元素的化合价为________。
(3)“氧化除砷锑”的工艺机理是粗铋熔融液在680~750℃的条件下,鼓入压缩空气,使砷、锑氧化挥发,同时空气也与铋液反应,利用Bi2O3的_______性将杂质砷、锑转变成As2O3、Sb2O3而除去。
(4)“氯化除铅”过程中,氯气与铅、铋反应分别生成PbCl2、BiCl3,生成的BiCl3又会被铅还原,发生反应3Pb+2BiCl3=3PbC12+2Bi,控制温度350-400℃,利用熔点和密度特点,氯化铅上浮至铋液表面呈_______态覆盖,防止氯气__________________。
(5)高温精炼的实质为碱性精炼,加入少量KNO3和NaOH,将锌氧化成锌酸盐而除去残锌,同时得到氮气,写出高温精炼的化学方程式: __________________。
(6)向含有MnSO4的酸性溶液中加入铋酸钠粉末,溶液变为紫红色,该反应经常用来检验Mn2+,写出该反应的离子方程式__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关浓硝酸的说法中错误的是( )
A.浓HNO3能溶解金属铜,说明其具有强酸性
B.浓HNO3能与碳反应,说明其具有强氧化性
C.浓HNO3不稳定易分解,需要避光保存
D.常温下浓HNO3能使金属铝钝化,可以用铝槽车运输浓HNO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(Ⅰ)工业上通常采用CO(g)和H2(g)催化合成甲醇CH3OH(g)。
(1)已知在某温度和压强下:
①2CO(g)+O2(g)=2CO2(g) △H= -566.0 kJ·mol-1
②2H2(g)+O2(g)=2H2O(g) △H= - 483.6 kJ·mol-1
③2CH3 OH(g)+3O2(g)=2CO2(g)+4H2 O(g) △H= -1275.6 kJ·mol-1
则在相同的温度和压强下,CO(g)与H2(g)合成CH3OH(g)的热化学方程式是_________________________________________________________。
(2)某化学研究性学习小组模拟工业合成甲醇的反应,在容积固定为2L的密闭容器内充入1 molCO和 2 molH2,加入合适催化剂(体积可以忽略不计)后在250°C开始反应,甲醇的物质的量的变化如下:
反应时间/min | 0 | 5 | 10 | 15 | 20 | 25 |
甲醇/mol | 0 | 0.22 | 0.36 | 0.45 | 0.5 | 0.5 |
则从反应开始到20min时,以CO表示的平均反应速率=_________________,该温度下平衡
常数K=________________,若升高温度则K值__________(填“增大”、“减小”或“不变”);
(3)下列描述中能说明上述反应已达平衡的是________________;
A.2 v (H2)正= v (CH3OH)逆 B.容器内气体的平均摩尔质量保持不变
C.容器中气体的压强保持不变 D.单位时间内生成 n molCO 的同时生成 2n molH2
(Ⅱ)回答下列问题:
(1)体积均为100mL pH=2的CH3COOH与一元酸HX,加水稀释过程中pH与溶液体积的关系如图所示,则Ka(HX) ______ Ka(CH3COOH)(填>、<或=)
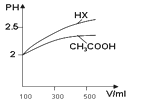
(2)25℃时,CH3COOH与CH3COONa的混合溶液,若测得pH=6,则溶液中C(CH3COO)- c(Na+)=________mol·L-1(填精确值)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】进入冬季北方开始供暖后,雾霾天气愈发严重,各地PM2.5、PM10经常“爆表”.引发雾霾天气的污染物中,最为常见的是机动车尾气中的氮氧化物和燃煤产生的烟气.
(1)Ⅰ、已知反应N2O4(g)2NO2(g)△H,随温度升高,混合气体的颜色变深.将一定量N2O4气体充入绝热容器一段时间后,研究压缩和拉伸活塞过程中混合气体的气体的透光率(气体颜色越浅,透光率越大)随时间变化情况.下列说法能说明透光率不再发生改变的有 . a.气体颜色不再改变 b.△H不再改变
c.v正(N2O4)=2v逆(NO2) d.N2O4的转化率不再改变
(2)Ⅱ、用NH3催化还原NOx可以消除氮氧化物的污染.下图,采用NH3作还原剂,烟气以一定的流速通过两种不同催化剂,测量逸出气体中氮氧化物含量,从而确定烟气脱氮率(注:脱氮率即氮氧化物转化率),反应原理为:NO(g)+NO2(g)+2NH3(g)2N2(g)+3H2O(g).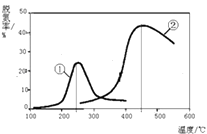
a.该反应的△S0(填“>”、“=”或“<”).
b.以下说法正确的是 .
A.第②种催化剂比第①种催化剂脱氮率高
B.相同条件下,改变压强对脱氮率没有影响
C.催化剂①、②分别适合于250℃和450℃左右脱氮
(3)Ⅲ、用CH4催化还原NOx也可以消除氮氧化物的污染.a.已知:CH4(g)的标准燃烧热为﹣890kJ/mol,蒸发1mol H2O(l)需要吸收44kJ热量.
CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H=﹣1114kJ/mol
2NO(g)+O2(g)═2NO2(g)△H=﹣114kJ/mol
写出CH4催化还原NO2(g)生成N2和H2O(g)的热化学方程式: .
b.在温度为T1℃和T2℃时,分别将0.5mol CH4和1.2mol NO2充入体积为1L的密闭容器中,测得NO2的物质的量随时间变化数据如下表:
时间/min | 0 | 10 | 20 | 40 | 50 |
T1 | 1.2 | 0.9 | 0.7 | 0.4 | 0.4 |
T2 | 1.2 | 0.8 | 0.56 | … | 0.5 |
①温度为T1℃时,0~20min内,v(CH4)= .
②T1T2(填“>”或“<”,下空同);判断理由是 .
③T1℃时,反应CH4(g)+2NO2(g)N2(g)+CO2(g)+2H2O(g)平衡常数K= .
④温度为T2℃时,达平衡后,再向容器中加入0.5mol CH4和1.2mol NO2 , 达新平衡时CH4的转化率将(填“增大”、“减小”或“不变”).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)0.3molNH3分子中所含原子数与___________个H2O分子中所含原子数相等。
(2)含0.4molAl3+的Al2(SO4)3中所含的硫酸根离子的物质的量是___________。
(3)相同质量的SO2、SO3的物质的量之比为__________;氧原子的个数之比为_____________。
(4)19g某二价金属氯化物(ACl2)中含有0.4molCl-,则ACl2的摩尔质量是_________;ACl2的化学式是_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com