
在下列变化中,①I2的升华,②烧碱熔化,③NaCl溶于水,④HCl溶于水,⑤O2溶于水,⑥Na2O2溶于水,未发生化学键破坏的是________;仅发生离子键破坏的是________;仅发生共价键破坏的是________;既发生共价键破坏又发生离子键破坏的是________。
科目:高中化学 来源: 题型:
有人认为人体实际上是一架缓慢氧化着的“高级机器”,人体在生命过程中也需要不断的补充“燃料”.按照这种观点,你认为人们通常摄入的下列物质不能看作“燃料”的是( )
|
| A. | 葡萄糖 | B. | 水 | C. | 油脂 | D. | 蛋白质 |
查看答案和解析>>
科目:高中化学 来源: 题型:
已知卤代烃可以跟金属钠反应生成碳链较长的烃,如:CH3Cl+2Na+CH3Cl→CH3﹣CH3+2NaCl,现有CH3CH2Br和CH3﹣CHBr﹣CH3的混合物与金属钠反应后,不可能得到的烃是( )
|
| A. | 2﹣甲基丁烷 | B. | 2﹣甲基戊烷 |
|
| C. | 2,3﹣二甲基丁烷 | D. | 丁烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定温度下,一定体积的密闭容器中有如下平衡:H2(g)+I2(g)2HI(g)。已知H2和I2的起始浓度均为0.10 mol·L-1,达平衡时HI的浓度为0.16 mol·L-1。则平衡时H2的浓度(mol·L-1)是( )
A.0.16 B.0.08
C.0.04 D.0.02
查看答案和解析>>
科目:高中化学 来源: 题型:
将纯锌片和纯铜片按图示方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是( )
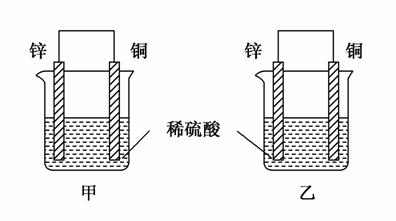
A.两烧杯中铜片表面均无气泡产生
B.甲中铜片是正极,乙中铜片是负极
C.两烧杯中溶液的酸性均减弱
D.产生气泡的速率甲比乙慢
查看答案和解析>>
科目:高中化学 来源: 题型:
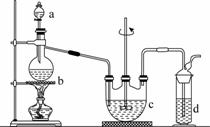
硫代硫酸钠(Na2S2O3)可用做分析试剂及鞣革还原剂。它易溶于水,不溶于醇,受热、遇酸易分解。工业上可用反应:2Na2S+Na2CO3+4SO2===3Na2S2O3+CO2制得。实验室模拟该工业过程的装置如图所示。
回答下列问题:
(1)b中反应的离子方程式为________________,c中试剂为________。
(2)反应开始后,c中先有浑浊产生,后又变澄清。此浑浊物是________。
(3)d中的试剂为________。
(4)实验中要控制SO2生成速率,可以采取的措施有___________________________________(写出两条)。
(5)为了保证硫代硫酸钠的产量,实验中通入的SO2不能过量,原因是______________________。
(6) 所得产品常含有少量Na2SO3和Na2SO4。为验证产品中含有Na2SO3和Na2SO4,该小组设计了以下实验方案,请将方案补充完整。(所需试剂从稀HNO3、稀H2SO4、稀盐酸、蒸馏水中选择)
①取适量产品配成稀溶液,滴加足量BaCl2溶液,有白色沉淀生成,________________,若沉淀未完全溶解,并有刺激性气味的气体产生,则可确定产品中含有Na2SO3和Na2SO4。
②为减少装置C中生成Na2SO4的量,在实验过程中应注意的操作顺序是_____________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
化学反应中,有时存在“一种物质过量,另一种物质仍不能完全反应”的特殊情况。下列反应中,属干这种情况的是
①过量锌与18 mol/L的硫酸反应;
②过量氢气与少量氮气在催化剂存在下充分反应;
③浓盐酸与过量的MnO2反应;
④过量铜与浓硫酸反应;
⑤过量稀硝酸与银反应;
⑥过量稀硫酸与大块状石灰石反应。
A.②③④⑥ B.②③⑤ C.①④⑤ D.①②③④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
利用反应2NO(g)+2CO(g)2CO2(g)+N2(g) ΔH=-746.8 kJ·mol-1,可净化汽车尾气,如果要同时提高该反应的速率和NO的转化率,采取的措施是( )
A.降低温度
B.增大压强同时加催化剂
C.升高温度同时充入N2
D.及时将CO2和N2从反应体系中移走
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com