

| 滴定序号 | 待测液体积/mL | 标准液滴定管起点读数/mL | 标准液滴定管终点读数/mL |
| 1 | 25.00 | 0.06 | 24.04 |
| 2 | 25.00 | 0.02 | 24.02 |
| 3 | 25.00 | 0.12 | 24.14 |
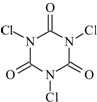 ,三氯异氰尿酸的分子式为C3N3O3Cl3;水解产物中的氧化性物质X可消毒灭菌,由该物质的元素组成可知水解生成HClO;故答案为:C3N3O3Cl3;HClO;
,三氯异氰尿酸的分子式为C3N3O3Cl3;水解产物中的氧化性物质X可消毒灭菌,由该物质的元素组成可知水解生成HClO;故答案为:C3N3O3Cl3;HClO;| 1 |
| 2 |
| 100ml |
| 25ml |
| 0.5112g |
| 0.5680 |


 智慧小复习系列答案
智慧小复习系列答案科目:高中化学 来源: 题型:
 A、B、X、Y、Z是元素周期表前四周期中的常见元素,原子序数依次增大.A元素可形成自然界硬度最大的单质;B与A同周期,核外有三个未成对电子;X原子的第一电离能至第四电离能分别是:I1=578kJ/mol,I2=1817kJ/mol,I3=2745kJ/mol,I4=11575kJ/mol;常温常压下,Y单质是固体,其氧化物是形成酸雨的主要物质;Z的一种同位素的质量数为63,中子数为34.请回答下列问题.
A、B、X、Y、Z是元素周期表前四周期中的常见元素,原子序数依次增大.A元素可形成自然界硬度最大的单质;B与A同周期,核外有三个未成对电子;X原子的第一电离能至第四电离能分别是:I1=578kJ/mol,I2=1817kJ/mol,I3=2745kJ/mol,I4=11575kJ/mol;常温常压下,Y单质是固体,其氧化物是形成酸雨的主要物质;Z的一种同位素的质量数为63,中子数为34.请回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 (1)用系统命名法命名下列物质
(1)用系统命名法命名下列物质
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、共价化合物里,一定不存在离子键 |
| B、在离子化合物里,只存在离子键 |
| C、化学键可以使离子结合,也可以使原子结合 |
| D、在化学反应过程中,反应物分子内的化学键断裂 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| 点燃 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com