
【题目】KAl(SO4)2·12H2O(明矾)是一种复盐,在造纸等方面应用广泛。实验室中,采用废易拉罐(主要成分为Al,含有少量的Fe、Mg杂质)制备明矾的过程如下图所示。回答下列问题:
![]()
![]()
![]()
![]()
![]()
![]()
![]()
(1)为尽量少引入杂质,试剂①应选用________(填标号)。
a.HCl溶液 b.H2SO4溶液 c.氨水 d.NaOH溶液
(2)易拉罐溶解过程中主要反应的化学方程式为_______________________。
 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案科目:高中化学 来源: 题型:
【题目】有关催化剂的催化机理等问题可从“乙醇催化氧化实验”得到一些认识,其实验装置如图所示。其实验操作为预先使棉花团浸透乙醇,并按照图示安装好装置;在铜丝的中间部分加热,片刻后开始(间歇性)鼓入空气,即可观察到明显的实验现象。

请回答以下问题:
(1)被加热的铜丝处发生反应的化学方程式为________________________________。
(2)从A管中可观察到____________的实验现象。从中可认识到在该实验过程中,催化剂参加了化学反应,还可认识到催化剂起催化作用时需要一定的_______________________。
(3)实验一段时间后,如果撤掉酒精灯,反应还能否继续进行?__________,原受热部分的铜丝有什么现象?____________,产生这种现象是因为_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列有关溶液的说法正确的是( )
A. pH相等的①NH4Cl、②NH4Al(SO4)2、③NH4HSO4溶液:浓度的大小顺序为①>②>③
B. HA的电离常数Ka =4.93×1010,则等浓度的NaA、HA混合溶液中:c(Na+) >c(HA) >c(A)
C. NaHCO3溶液加水稀释,c(Na+)与c(HCO3)的比值将减小
D. 已知在相同条件下酸性HF >CH3COOH,则物质的量浓度相等的NaF与CH3COOK溶液中:c(Na+) – c(F) >c(K+ ) c(CH3COO)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素W、X、Y、Z在周期表中的位置如图,其中Y所处的周期数与族序数相等,W最外层电子数是其内层电子数的3倍。下列说法不正确的是![]()
… | W | |||
X | Y | … | Z |
A.X、Y、Z、W的原子半径依次减小
B.W与X形成的化合物中只含有离子键
C.气态氢化物的稳定性:W>Z
D.W与Y形成的化合物可分别与NaOH溶液和盐酸反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合理利用资源成为当今研究热点。CH3NH2、PbI2及HI常用作合成太阳能电池的敏化剂甲胺铅碘(CH3NH3PbI3)的主要原料。
(1)制取甲胺的反应为CH3OH(g)+NH3(g)![]() CH3NH2(g)+H2O(g) ΔH。已知该反应中相关化学键的键能数据如下:
CH3NH2(g)+H2O(g) ΔH。已知该反应中相关化学键的键能数据如下:
共价键 | C-O | H-O | N-H | C-N |
键能/kJ·mol-1 | E1 | E2 | E3 | E4 |
则上述热化学方程式中ΔH=___kJ·mol-1。
(2)可利用水煤气合成上述反应所需甲醇。反应为CO(g)+2H2(g)![]() CH3OH(g)ΔH<0。在一定条件下,将1molCO和2molH2通入密闭容器中进行反应,当改变某一外界条件(温度或压强)时,CH3OH的体积分数φ(CH3OH)变化趋势如图所示:
CH3OH(g)ΔH<0。在一定条件下,将1molCO和2molH2通入密闭容器中进行反应,当改变某一外界条件(温度或压强)时,CH3OH的体积分数φ(CH3OH)变化趋势如图所示:

①平衡时,M点CH3OH的体积分数为10%,则CO的转化率为___。
②图中Y轴表示温度,其判断的理由是__。
(3)可利用四氧化三铅和氢碘酸反应制备难溶PbI2,若反应中生成amolPbI2,则转移电子的物质的量为___。
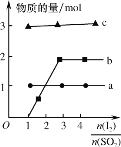
(4)将二氧化硫通入碘水制备HI的反应曲线如图所示,其反应原理为:SO2+I2+2H2O=3H++HSO4-+2I-,I2+I-![]() I3-,图中曲线a、b分别代表的微粒是__和__(填微粒符号);由图知要提高碘的还原率,除控制温度外,还可以采取的措施是___。
I3-,图中曲线a、b分别代表的微粒是__和__(填微粒符号);由图知要提高碘的还原率,除控制温度外,还可以采取的措施是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
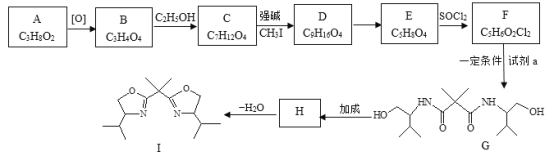
【题目】双功能手性催化剂在药物合成中起到重要的作用。其中一种催化剂I的合成路线如下:
已知:R-NH2+![]()
![]()
![]()
(1)A可与Na反应可生成H2,则A中的官能团名称是_________。
(2)下列关于A的说法中,正确的是_________。
a.与乙醇互为同系物
b.与B在一定条件下可发生缩聚反应
c.发生消去反应的试剂和条件是:NaOH的醇溶液、加热
(3)写出B→C的化学方程式:___________。
(4)D的结构简式是__________。
(5)E→F的反应类型是___________。
(6)已知:NH3+![]() →H2N-CH2CH2OH,NH3和物质K发生反应可以制备试剂a,K的结构简式是__________。
→H2N-CH2CH2OH,NH3和物质K发生反应可以制备试剂a,K的结构简式是__________。
(7)F与对苯二胺(![]() )在一定条件下可发生缩聚反应制备尼龙MXD6的衍生品,该反应的化学方程式是___________。
)在一定条件下可发生缩聚反应制备尼龙MXD6的衍生品,该反应的化学方程式是___________。
(8)H的结构简式是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】新型NaBH4/H2O2燃料电池DBFC的结构如图所示,该电池总反应方程式:NaBH4 +4H2O2= NaBO2+ 6H2O,有关的说法不正确的是

A. 电极B为正极
B. 放电过程中,Na+从正极区向负极区迁移
C. 电池负极的电极反应为:BH4-+8OH8e=BO2-+6H2O
D. 在电池反应中,每消耗1L6mol/LH2O2溶液,理论上流过电路中的电子为12NA
查看答案和解析>>
科目:高中化学 来源: 题型:
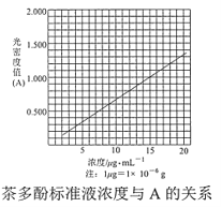
【题目】茶叶中的茶多酚是一种天然抗氧化剂(其抗氧化能力是VC的5~10倍),它易溶于水、乙醇、乙酸乙酯,难溶于氯仿。在酸性介质中,茶多酚能将Fe3+还原为Fe2+,Fe2+与K3Fe(CN)6生成的深蓝色配位化合物KFe[Fe(CN)6]对特定波长光的吸收程度(用光密度值A表示)与茶多酚在一定浓度范围内成正比。A与茶多酚标准液浓度的关系如图所示:
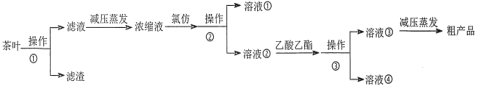
某实验小组设计如下实验流程从茶叶中提取茶多酚:
请回答下列问题:
(1)操作①用水浸取茶多酚时,实验小组发现搅拌速度对茶多酚浸出量的影响如图1所示,原因是_____。若用乙醇浸取茶多酚操作如下:称取 10 g 茶叶末,用滤纸包好,装入________________中,圆底烧瓶内加___________和适量乙醇,如图2安装后, 通冷凝水,加热套加热,当乙醇被加热沸腾后,控制加热套温度在 90℃。为使恒压漏斗内液面高出茶叶包约 0.5 cm,并保持约 1 h,可行的操作方法是_________。
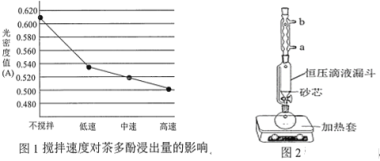
(2)减压蒸发相对于一般蒸发的优点是_____________;氯仿的作用是_________________。
(3)下列有关实验基本操作不正确的是____________。
A.图2中冷凝水流向为a进b出
B.分液漏斗使用前须检验是否漏水并洗净备用
C.操作①过滤时,可用玻璃棒适当搅拌以加快分离速度
D.萃取过程中,经振摇并放气后,将分液漏斗置于铁圈上立即分液
(4)称取 1.25 g 粗产品,用蒸馏水溶解并定容至 1000 mL,移取该溶液 1.00 mL,加过量 Fe3+和_______酸性溶液,用蒸馏水定容至 100 mL 后,测得溶液光密度值 A=0.800,则产品的纯度是______(以质量分数表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com