
下列化学反应的离子方程式正确的是 ( )
A.在稀氨水中通入过量CO2:NH3·H2O+CO2===NH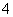 +HCO
+HCO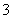
B.少量SO2通入漂白粉溶液中:SO2+H2O+Ca2++2ClO-===CaSO3↓+2HClO
C.用稀HNO3溶解FeS固体:FeS+2H+===Fe2++H2S↑
D.向NH4HCO3溶液中加入足量Ba(OH)2溶液:2HCO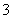 +Ba2++2OH-===BaCO3↓+CO
+Ba2++2OH-===BaCO3↓+CO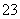 +2H2O
+2H2O
 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案科目:高中化学 来源: 题型:
已知A物质的分子结构如下: 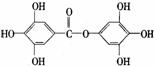 , 1 mol A与足量的
, 1 mol A与足量的
NaOH溶液混合共热,充分反应后最多消耗NaOH的物质的量为
A.6mol B.7mol C.8mo1 D.9mo1
查看答案和解析>>
科目:高中化学 来源: 题型:
硫酸工业 尾气中二氧化硫的含量超过 0.05%(体积分数)时需经处理后才能排放。某校兴趣小组欲测定硫酸工业尾气中二氧化硫的含量,采用以下方案:
尾气中二氧化硫的含量超过 0.05%(体积分数)时需经处理后才能排放。某校兴趣小组欲测定硫酸工业尾气中二氧化硫的含量,采用以下方案:
甲方案:如下图所示,图中气体流量计B用于准确测量通过尾气的体积。将尾气通入一定体积已知浓度的碘水中测定SO2的含量。当洗气瓶C中溶液蓝色消失时,立即关闭活塞A。
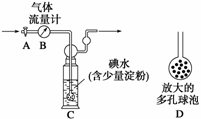
(1)洗气瓶C中导管末端连接一个多孔球泡D,可以提高实验的准确度,其理由是________________________________________________________________________
________________________________________________________________________。
(2)洗气瓶C中的溶液可以用其他试剂替代,请你举出一种:__________________。
(3)洗气瓶C中溶液蓝色消失后,没有及时关闭活塞A,测得的SO2含量__________(填“偏高”、“偏低”或“无影响”)。
乙方案:实验步骤如下面流程图所示:
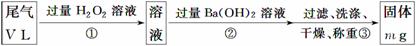
(4)写出步骤②中反应的化学方程式________________________________________。
(5)步骤③中洗涤沉淀的方法是____________________________________________。
(6)通过的尾气体积为V L(已换算成标准状况)时,该尾气中二氧化硫的含量(体积分数)为______________(用含有V、m的代数式表示)。
丙方案:将乙方案中步骤①省略,直接将尾气通入过量Ba(OH)2溶液中,其余步骤与乙方案相同。
(7)你认为丙方案是否合理,说明理由:______________________________________
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于硫及其化合物的说法中正确的是 ( )
A.自然界中不存在游离态的硫
B.二氧化硫的排放会导致光化学烟雾的产生
C.二氧化硫能使滴有酚酞的氢氧化钠溶液褪色,体现了其漂白性
D.浓硫酸可用来干燥SO2、CO、Cl2等气体
查看答案和解析>>
科目:高中化学 来源: 题型:
中学化学中几种常见物质的转化关系如下图(部分产物未列出)。A是一种金属单质,D是一种非金属固体单质。

请回答下列问题:
(1)A、C的化学式分别为A__________,C__________。
(2)F的浓溶液与A反应过程中,F体现的性质与下列反应中H2SO4体现的性质完全相同的是__________(填字母序号)。
A.C+2H2SO4(浓) CO2↑+2SO2↑+2H2O
CO2↑+2SO2↑+2H2O
B.Fe+H2SO4===FeSO4+H2↑
C.Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O
D.FeO+H2SO4===FeSO4+H2O
(3)写出反应E+H2O2―→F的化学方程式:__________________________________。
(4)若反应F+D―→E转移电子数为6.02×1023,则消耗D的质量为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知33As、35Br位于同一周期,下列关系正确的是
A.原子半径:As>C1>P B.热稳定性:HC1>AsH3>HBr
C.还原性:As3->S2->C1- D.酸性:H3AsO4>H2SO4>H3PO4
查看答案和解析>>
科目:高中化学 来源: 题型:
我国的四大发明之一黑火药,爆炸时发生反应的化学方程式为: S+2KNO3 +3C→K2S +3CO2↑+N2↑。
请根据其中所含的元素回答下列问题:
(1)如图所示为元素周期表中钾元素框图,数据“39.10”表示的是_________;钾元素在周期表中的位置为_________。
(2)上述元素中,简单离子电子层结构与氩原子相同,且离子半径最大的元素,其氧化物中一种对应水化物能与氯单质反应,该反应的化学方程式是 __________________________________________________。
(3)上述反应生成物中,属于非电解质的是________(写结构式);其中熔点最高的物质的电子式是_________。
(4)上述化学方程式的元素中,属于同周期元素的非金属性由强到弱的顺序为_________,能证明其递变规律的事实是( )(填字母)
A.最高价氧化物对应水化物的酸性 B.气态氢化物的沸点
C.单质与氢气反应的难易程度 D.其两两组合形成的化合物中元素的化合价
查看答案和解析>>
科目:高中化学 来源: 题型:
某无色溶液中能大量共存的一组离子是 ( )
A.OH-、Ba2+、NH4+、Cl- B.Na+、Al3+、Cl-、NO3-
C .K+、Fe2+、H+、NO3- D.Mg2+、SO42-、SiO32- 、H+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com