
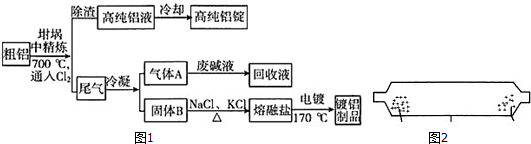
分析 粗铝700°C通入氯气在坩埚中精炼,将Cl2连续通入坩埚中的粗铝熔体,杂质随气泡上浮除去.气泡的主要成分除Cl2外还含有H2、HCl、AlCl3,除渣得到高纯铝液和尾气,高纯铝液冷却得到高纯铝锭,尾气冷凝得到气体A为Cl2,废碱液回收得到回收液;B固体加入氯化钠氯化钾加热得到熔融盐电镀得到镀铝制品;
(1)NaCl熔点为801℃;AlCl3在181℃升华,据此分析分离的温度;
(2)根据题中信息:NaCl熔点为801℃;AlCl3在181℃升华,在结合物质之间的反应来分析;
(3)酸性气体能和强碱反应,用烧碱来处理尾气,氯气和氢氧化钠溶液反应生成氯化钠、次氯酸钠和水;
(4)电镀池中镀件金属作阳极,金属发生氧化反应,钢材做阴极得到电子发生还原反应,熔融盐电镀池中存在Na+?K+?AlCl4-?Al2Cl7-等离子分析;
(5)根据氧化铝的性质稳定来回答,铝金属表面形成的致密氧化铝膜具有保护作用.
解答 解:粗铝700°C通入氯气在坩埚中精炼,将Cl2连续通入坩埚中的粗铝熔体,杂质随气泡上浮除去.气泡的主要成分除Cl2外还含有H2、HCl、AlCl3,除渣得到高纯铝液和尾气,高纯铝液冷却得到高纯铝锭,尾气冷凝得到气体A为Cl2,废碱液回收得到回收液;B固体加入氯化钠氯化钾加热得到熔融盐电镀得到镀铝制品;
(1)NaCl熔点为801℃;AlCl3在181℃升华,把NaCl和AlCl3的固体混合物置于如图所示的装置的一端,加热到181℃氯化铝变化为气体升华,在另一端冷凝分离,
故答案为:181;
(2)粗铝含有一定量的金属钠和氢气,钠、铝和氯气反应生成了氯化钠和氯化铝,氢气和氯气发生反应生成氯化氢,其中氯化钠熔点为801℃,较高,是固态杂质随气泡上浮,气泡的主要成分除Cl2外还含有H2、HCl、AlCl3,故答案为:H2、HCl、AlCl3;NaCl;
(3)A中有氯气以及氯化氢,均能和烧碱反应,用于尾气处理,实质为:Cl2+2OH-=Cl-+ClO-+H2O,H++OH-=H2O,故答案为:Cl2+2OH-=Cl-+ClO-+H2O;
(4)电镀池中镀件金属铝作阳极,金属铝失电子发生氧化反应,熔融盐电镀池中存在Na+?K+?AlCl4-?Al2Cl7-等离子,钢材做阴极,表面(电极)的电极反应式为:AlCl4-+3e-═Al+4Cl-或Al2O7-+6e-=2Al+7Cl-,
故答案为:阳;AlCl4-?Al2Cl7-;Al2O7-+6e-=2Al+7Cl-;
(5)铝金属表面形成的致密氧化铝膜具有保护作用,致密的氧化膜能隔绝钢材与空气中的O2、CO2和H2O等接触,使电化学腐蚀和化学腐蚀不能发生,
故答案为:氧化铝膜.
点评 本题考查了物质分离提纯的流程分析判断,物质性质和试剂作用于产物的判断是解题关键,是一道有关金属的工业制备知识题目,考查角度广,难度中等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{2a}{3V}$mol/L | B. | $\frac{a}{3V}$mol/L | C. | $\frac{a}{6V}$mol/L | D. | $\frac{a}{4V}$mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 锌是正极,铜是负极 | B. | H+在溶液里流向锌片 | ||
| C. | 负极发生还原反应 | D. | 电子经外电路由锌流向铜 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com