
【题目】苯和溴的取代反应的实验装置如图所示。其中A为带支管的试管改成的反应容器,在其下端开了一小孔,塞好石棉绒,再加入铁屑粉少量。

(1)向反应容器A中逐滴加入溴和苯的混合液,几秒钟内就发生反应。写出A中所发生反应的化学方程式:____________、____________;试管C中苯的作用____________。
(2)反应开始后,D、E试管的现象分别为__________________、____________; E中所发生反应的离子方程式为____________。
(3)在上述整套装置中,具有防倒吸作用的仪器有(填字母) ____________。
(4)上述实验装置除①步骤简单,操作方便,成功率高;②各步现象明显;③对产品便于观察这3个优点外,还有一个优点____________。
【答案】3Br2+2Fe=2FeBr3 ![]() +Br2→
+Br2→![]() +HBr 吸收溴蒸汽 溶液变红,管口有白雾产生 产生浅黄色沉淀,管口有白雾产生 Br-+Ag+=AgBr↓ DEF 充分吸收有毒气体,防止大气污染
+HBr 吸收溴蒸汽 溶液变红,管口有白雾产生 产生浅黄色沉淀,管口有白雾产生 Br-+Ag+=AgBr↓ DEF 充分吸收有毒气体,防止大气污染
【解析】
⑴向反应容器A中逐滴加入溴和苯的混合液,几秒钟内就发生反应。首先铁和溴发生化合反应,再是苯和液溴再溴化铁催化剂作用下发生取代反应,故反应化学方程式答案为
3Br2+2Fe=2FeBr3,![]() +Br2→
+Br2→![]() +HBr;苯和液溴发生取代反应生成溴化氢,该反应是放热反应,放出的热量使溴更易挥发,因此向C中过来的主要是溴化氢和溴蒸汽,因此试管C中苯主要吸收溴化氢气体中的溴蒸汽;
+HBr;苯和液溴发生取代反应生成溴化氢,该反应是放热反应,放出的热量使溴更易挥发,因此向C中过来的主要是溴化氢和溴蒸汽,因此试管C中苯主要吸收溴化氢气体中的溴蒸汽;
⑵反应开始后,从C中过来的是溴化氢气体,因此在D中看见的现象为溶液变红,管口有白雾产生,在E试管的现象产生浅黄色沉淀,管口有白雾产生,故答案分别为溶液变红,管口有白雾产生;浅黄色沉淀,管口有白雾产生;E中所发生反应的离子方程式为Br-+Ag+=AgBr↓;
⑶在上述整套装置中,具有防倒吸作用的仪器有(填字母) DEF;
⑷上述实验装置除①步骤简单,操作方便,成功率高;②各步现象明显;③对产品便于观察这3个优点外,还有一个优点充分吸收有毒气体,防止大气污染,故答案为充分吸收有毒气体,防止大气污染。


科目:高中化学 来源: 题型:
【题目】在相同的密闭容器中,不同温度下发生反应:2A(g)![]() 2B(g)+C(g) ΔH>0,气体A的浓度随时间t变化如下表所示。
2B(g)+C(g) ΔH>0,气体A的浓度随时间t变化如下表所示。
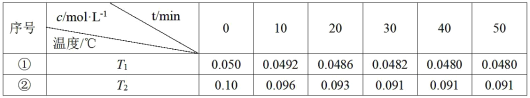
下列说法不正确的是( )
A.实验的温度:T2>T1
B.实验①前20min的平均反应速率v(C)=3.5×10-5molL-1min-1
C.实验②比实验①提前10min达到平衡
D.实验②中A的平衡转化率为9%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中华人民共和国国家标准(G2762011)规定葡萄酒中c最大使用量为0.25g/L.某兴趣小组用图装置(夹持装置略)收集某葡萄酒中SO2,并对含量进行测定。
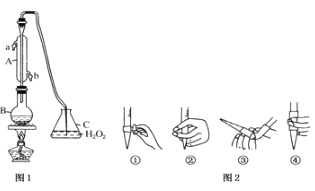
(1)仪器A的名称是________,水通入A的进口为_______________
(2)B中加入300.0ml葡萄酒和适量盐酸,加热使SO2全部逸出与C中H2O2完全反应其化学方程式为_________________________________
(3)除去C中过量的H2O2,然后用0.0900mol/LNaOH标准溶液进行滴定,滴定前排气泡时,应选择图2中的________;若滴定终点时溶液的pH=8.8,则选择的指示剂为________;若用50mL滴定管进行实验,当滴定管中的液面在刻度“20”处,则管内液体的体积______(填序号)
(①=20mL,②=30mL,③<20mL,④>30mL).
(4)滴定至终点时,消耗NaOH溶液12.50mL,该葡萄酒中SO2含量为:___g/L
(5)该测定结果比实际值偏高,分析原因并利用现有装置提出改进措施______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚氯酸钠(NaClO2)是一种重要漂白剂,实验室可按下图装置制取NaClO2晶体。

已知:Ⅰ.A中发生的反应为:2ClO2+H2O2+2NaOH=2NaClO2+O2+2H2O
Ⅱ.NaClO2受热易分解,温度高于60℃时分解成NaClO3和NaCl。
(1)已知ClO2与Cl2类似具有漂白性,请设计检验ClO2漂白性的实验方案______。
(2)A中用冰水浴的目的是______。
(3)装置B的作用是______。
(4)测定样品中NaClO2的质量分数的实验过程如下:
步骤一:称0.5000 g样品,加入适量蒸馏水和过量的KI晶体和硫酸,发生如下反应:ClO![]() +4I﹣+4H+=2H2O+2I2+Cl﹣
+4I﹣+4H+=2H2O+2I2+Cl﹣
步骤二:将所得混合液稀释成100 mL待测溶液。取25.00 mL待测溶液,加入淀粉溶液作指示剂,用0.2000 mol·L-1 Na2S2O3标准液滴定至终点,测得消耗标准溶液体积的平均值为15.00 mL(滴定过程中发生反应:I2+2S2O32-=2I﹣+S4O62-)。
①配制100 mL 0.2000 mol·L-1Na2S2O3标准溶液需要用到的玻璃仪器有烧杯、胶头滴管、______。
②请计算所称取样品中NaClO2的质量分数_______________。(写出计算过程)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验装置不能达到实验目的的是
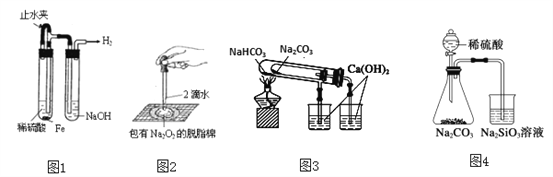
A. 图1:制备并观察氢氧化亚铁
B. 图2:证明过氧化钠与水反应放热
C. 图3:验证NaHCO3和Na2CO3的热稳定性
D. 图4:验证酸性强弱H2SO4>H2CO3>H2SiO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜矾(主要成分 CuSO4·5H2O)是一种可用于食品添加的铜强化剂。现以某硫铁矿渣(含有 CuSO4、CuSO3、Cu2O及少量难溶于酸的Cu2S、CuS)制备铜矾的工艺过程如下:
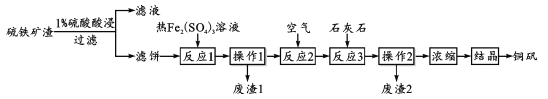
(1)“1%硫酸酸浸”时,固液质量比为1:3并进行4~6次浸取,其目的是_________;
(2)“滤饼”中含有Cu,其中Cu在“反应1”中溶解的离子方程式为________;“废渣1”中只含有S单质,则“反应1”中Cu2S与Fe2(SO4)3反应的物质的量之比为_______。
(3)“反应2”中通入空气的目的是_______;结合离子方程式,说明“反应3”加入石灰石的作用________。
(4)为了提高硫铁矿渣的利用率和产品的产率,在“浓缩”前进行的必要操作是_____;分析下列溶解度信息,最适宜的结晶方式为_________。
t/℃ | 0 | 10 | 20 | 30 | 40 | 60 | 80 |
CuSO4·5H2O/(g/100g H2O) | 23.1 | 27.5 | 32.0 | 37.8 | 44.6 | 61.8 | 83.8 |
(5)将铜矾、生石灰、水按质量比依次为1.0:0.56:100混合配制无机铜杀菌剂波尔多液,其有效成分为CuSO4·xCu(OH)2·yCa(OH)2。当x=1时,试确定y的值为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验方案合理的是________
A.配制银氨溶液:在一定量![]() 溶液中,滴加氨水至沉淀恰好溶解
溶液中,滴加氨水至沉淀恰好溶解
B.检验RX中的卤素原子,把RX与烧碱水溶液混合加热后,将溶液冷却再加入硝酸银溶液
C.无水乙醇和浓硫酸共热至170℃,将制得的气体通入酸性高锰酸钾溶液,可检验制得的气体是否为乙烯
D.实验室制取乙烯时,必须将温度计的水银球插入反应液中,测定反应液的温度
E.乙烷中混有乙烯,通过氢气在一定条件下反应,使乙烯转化为乙烷
F.用氨水清洗做过银镜反应的试管
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以废旧磷酸亚铁锂正极材料(主要成分为LiFePO4,含炭黑、铝等杂质)为原料可制备LiOH溶液和FePO4。
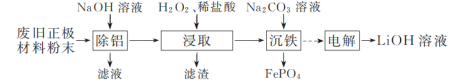
(1)“除铝”时反应的离子方程式为______________________________。
(2)试从沉淀溶解平衡移动的角度解释“浸取时加入H2O2、稀盐酸”可促进LiFePO4溶解的原因:______。
(3)“浸取”所得滤液中,磷元素的存在形式主要是________(填字母)。
a. PO![]() b. H3PO4 c. H2PO
b. H3PO4 c. H2PO![]()
(4)“沉铁”时铁、磷的沉淀率随溶液pH的变化如图1所示。pH>2.5后磷元素的沉淀率逐渐下降,原因是_____________________。
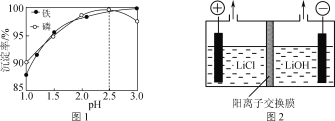
(5)“电解”制备LiOH的原理如图2所示,装置中使用阳离子交换膜将电解槽隔成阳极室和阴极室的目的是________________________________________。
(6)LiOH和(NH4)2Fe(SO4)2、H3PO4反应得到LiFePO4、NH4HSO4。写出该反应的化学方程式:__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上采用的一种污水处理方法如下:保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3。Fe(OH)3具有吸附性,可吸附污物而沉积下来,有净化水的作用。阴极产生的气泡把污水中悬浮物带到水面形成浮渣层,刮去(或撇掉)浮渣层,即起到了浮选净化的作用。某科研小组用该原理处理污水,设计装置如图所示。下列说法正确的是
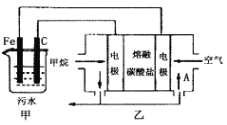
A.为了增加污水的导电能力,应向污水中加入适量的H2SO4溶液
B.甲装置中Fe电极的反应为Fe-3e-=Fe3+
C.当乙装置中有1.6gCH4参加反应,则C电极理论上生成气体体积为4.48L
D.为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定,电池工作时,循环的物质A为CO2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com