
【题目】将足量CO2气体通入硅酸钠溶液中,然后加热蒸干,再在高温下充分反应,最后所得的固体物质是
A. Na2SiO3 B. Na2CO3、Na2SiO3 C. Na2CO3、SiO2 D. SiO2
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】用锌片、铜片和稀硫酸组成的原电池,正极上发生的电极反应是
A. 2H++2e-=H2↑ B. Zn-2e-=Zn2+
C. 2H2O+O2+4e-=4OH- D. Cu2++2e-=Cu
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生用已知物质的量浓度的盐酸来测定未知物质的量浓度的NaOH溶液时,选择甲基橙作指示剂。请填写下列空白:
(1)用标准的盐酸滴定待测的NaOH溶液时,左手握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视________,直到因加入一滴盐酸后,溶液由黄色变为橙色,并___________为止。
(2)下列操作中可能使所测NaOH溶液的浓度数值偏低的是________(填序号)。
A.酸式滴定管未用标准盐酸润洗就直接注入标准盐酸
B.滴定前盛放NaOH溶液的锥形瓶用蒸馏水洗净后没有干燥
C.酸式滴定管在滴定前有气泡,滴定后气泡消失
D.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数
(3)若滴定开始和结束时,酸式滴定管中的液面如右图所示,所用盐酸溶液的体积为________mL。
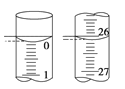
(4)某学生根据3次实验分别记录有关数据如下表:
滴定次数 | 待测NaOH溶液的体积/mL | 0.100 0 mol·L-1盐酸的体积/mL | ||
滴定前刻度 | 滴定后刻度 | 溶液体积/mL | ||
第一次 | 25.00 | 0.00 | 26.11 | 26.11 |
第二次 | 25.00 | 1.56 | 30.30 | 28.74 |
第三次 | 25.00 | 0.22 | 26.31 | 26.09 |
依据上表数据列式计算该NaOH溶液的物质的量浓度________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列除去杂质(括号内的物质是杂质)时,选用的试剂或方法正确的是( )
A | B | C | D | |
试样 | NaCl溶液(Na2CO3) | NH4Cl固体(I2) | CO2(SO2) | NaBr溶液(Br2) |
除杂试剂 或方法 | 澄清石灰水 | 加热 | NaOH溶液 | 用CCl4萃取、 分液 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)写出下列过程的化学方程式:
①CH3COOCH=CH2![]() A
A![]() B
B
聚合反应:______________________________________________
水解反应:_________________________________________________
②甘氨酸与盐酸反应:____________________________
(2)聚碳酸酯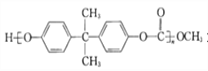 的透光率良好,可制作车、船、飞机的挡风玻璃等。原来合成聚碳酸酯的一种原料是有毒的光气(COCl2),现在改用绿色化学原料碳酸二甲酯
的透光率良好,可制作车、船、飞机的挡风玻璃等。原来合成聚碳酸酯的一种原料是有毒的光气(COCl2),现在改用绿色化学原料碳酸二甲酯![]() 与___________(填字母序号)缩合聚合而成。
与___________(填字母序号)缩合聚合而成。
a.二卤代物 b.二酚类 c.二醛类 d.二烯类
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苹果在中国已有两千多年的栽培历史, 有“ 智慧果” 的美称。
(1) 未成熟的苹果肉变蓝色的原因是______。
(2)苹果中也有少量脂肪。脂肪对人体所起的作用是_____。( 写一条)
(3)英国是苹果酒人均消费量最大的国家。苹果酒是由成熟度高的苹果在果胶、酶、酵母菌等的作用下。经一系列变化而制得的低度酒, 其中果胶酶、酵母菌都起作用_________ ; 由 葡 萄 糖 生 成 酒 精 的 反 应________________![]() 2C2H5OH+2CO2↑
2C2H5OH+2CO2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】香兰素是重要的香料之一,它可由丁香酚经多步反应合成。

有关上述两种化合物的说法正确的是
A. 常温下,1mol丁香酚只能与1molBr2反应
B. 丁香酚不能使FeCl3溶液发生显色反应
C. 1mol香兰素最多能与3mol氢气发生加成反应
D. 香兰素分子中至少有12个原子共平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用O2将HCl转化为Cl2,可提高效益,减少污染。
(1)传统上该转化通过如下图所示的催化剂循环实现,其中,反应①为:2HCl(g) + CuO(s)![]() H2O(g)+CuCl2(g) △H1,反应②生成1molCl2(g)的反应热为△H2,则总反应的热化学方程式为_____________________, (反应热用△H1和△H2表示)。
H2O(g)+CuCl2(g) △H1,反应②生成1molCl2(g)的反应热为△H2,则总反应的热化学方程式为_____________________, (反应热用△H1和△H2表示)。
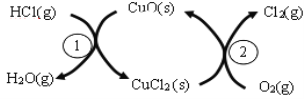
(2)新型RuO2催化剂对上述HCl转化为Cl2的总反应具有更好的催化活性。

①实验测得在一定压强下,总反应的HCl平衡转化率随温度变化的αHCl—T(HCl的转化率与温度的关系)曲线如右图,则总反应的△H__________0,(填“>”、“﹦”或“<”);A、B两点的平衡常数K(A)与K(B)中较大的是____________________。
②在上述实验中若压缩体积使压强增大,画出相应αHCl—T曲线__________,(在图中画出)并简要说明理由______________________。
③一定温度下,若该反应在某恒容容器中进行,下列能说明该反应已经达到化学平衡的是_________________________。
A、体系的压强不再改变
B、各反应物和生成物的浓度相等
C、混合气体的密度不再改变
D、混合气体的平均摩尔质量不再改变
(3)Cl2用途广泛,写出用Cl2制备漂白粉的化学方程式________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com