
【题目】下列说法正确的是
A. NaHCO3分解过程中,只需克服离子键
B. Na2O溶于水的过程中破坏了离子键和共价键,形成了新的离子键和共价键
C. O3、CO2和SiO2都是由分子构成的
D. 金刚石和足球烯(C60)均为原子晶体,沸点极髙
科目:高中化学 来源: 题型:
【题目】下列叙述中,正确的是( )
A. 铜和FeCl3溶液均能导电,但二者都不是电解质
B. 分解反应的生成物中一定有单质
C. 分散质粒子的直径在1×10-9cm~1×10-7cm之间的分散系属于胶体
D. 氯气不能使干燥的有色布条褪色,液氯能使干燥的有色布条褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国晋代《抱朴子》中描述了大量的化学反应,其中有:①“丹砂(HgS)烧之成水银,积变又还成丹砂”; ②“以曾青涂铁,铁赤色如铜”。下列有关叙述正确的是
A. ①中水银“积变又还成丹砂”说明水银发生了还原反应
B. ②中反应的离子方程式为:2Fe+3Cu2+=2Fe3++3Cu
C. 根据①可知温度计打破后可以用硫粉覆盖水银,防止中毒
D. 水银能跟曾青发生置换反应生成单质铜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将0.1 mol铜与40 mL 10 mol/L HNO3充分反应后,溶液中含a mol H+。由此可知
A.生成的气体在标准状况下的体积为4.48 L
B.生成的气体在标准状况下的体积为1.49 L
C.被还原的硝酸的物质的量为(0.2a)mol
D.反应后溶液中所含![]() 的物质的量为0.2 mol
的物质的量为0.2 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丁二酮肟(![]() )是检验Ni2+的灵敏试剂。
)是检验Ni2+的灵敏试剂。
(1)Ni2+基态核外电子排布式为________。丁二酮肟分子中C原子轨道杂化类型为________,1 mol丁二酮肟分子所含σ键的数目为________,分子中各原子的电负性由大到小的顺序为________________。
(2)Ni能与CO形成四羰基镍[Ni(CO)4],四羰基镍熔点-19.3 ℃,沸点42.1 ℃,易溶于有机溶剂。
①Ni(CO)4固态时属于________晶体(填晶体类型)。
②与CO互为等电子体的阴离子为____________(填化学式)。
(3)Ni2+与Mg2+、O2-形成晶体的晶胞结构如图所示(Ni2+未画出),则该晶体的化学式为_________________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应或操作会明显产生吸热现象的是
A. 将氢氧化钠溶液迅速倒入盛有盐酸的量热计中 B. 浓硫酸加水稀释
C. 氯化铵固体和氢氧化钡固体在烧杯中混合搅拌 D. 甲烷的燃烧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】周期表前三周期元素A、B、C、D,原子序数依次增大,A的基态原子的L层电子是K层电子的两倍;B的价电子层中的未成对电子有3个;C与B同族;D的最高价含氧酸为酸性最强的无机含氧酸。请回答下列问题:
(1)C的基态原子的电子排布式为_____________;D的最高价含氧酸酸性比其低两价的含氧酸酸性强的原因是___________________________。
(2)杂化轨道分为等性和不等性杂化,不等性杂化时在杂化轨道中有不参加成键的孤电子对的存在。A、B、C都能与D形成中心原子杂化方式为____________的两元共价化合物。其中,属于不等性杂化的是____________(写化学式)。以上不等性杂化的化合物价层电子对立体构型为_________,分子立体构型为_______________________________。
(3)以上不等性杂化化合物成键轨道的夹角________(填“大于”、“等于”或“小于”)等性杂化的化合物成键轨道间的夹角。
(4)A和B能形成多种结构的晶体。其中一种类似金刚石的结构,硬度比金刚石还大,是一种新型的超硬材料。其结构如下图所示(图1为晶体结构,图2为切片层状结构),其化学式为________________。实验测得此晶体结构属于六方晶系,晶胞结构见图3。已知图示原子都包含在晶胞内,晶胞参数a=0.64 nm,c=0.24 nm。其晶体密度为________________(已知:![]() =1.414,
=1.414,![]() =1.732, 结果精确到小数点后第2位)。
=1.732, 结果精确到小数点后第2位)。
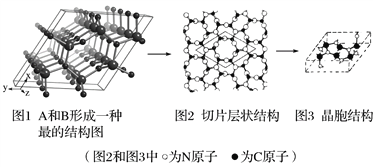
查看答案和解析>>
科目:高中化学 来源: 题型:
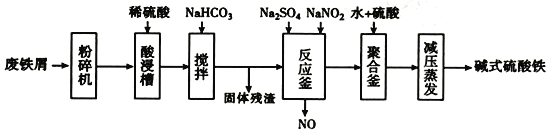
【题目】碱式硫酸铁[Fe(OH)SO4]是一种用于污水处理的新型髙效絮凝剂,在医药上也可于治疗消化性溃疡出血。工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁的流程如下:
已知:
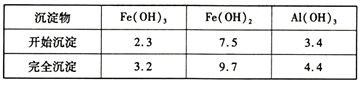
部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
回答下列问题:
(1)粉碎过筛的目的是____________________。
(2)加入少量NaHCO3的目的是________。
(3)反应釜中发生反应的离子方程式为_______________________。在实际生产中,常同时通入02以减少NaNO2的用量,若参与反应的O2有11.2L(标准状况),则相当于约NaNO2的物质的量为________。
(4)聚合釜中溶液的PH必须控制在一定的范围内。PH偏小时Fe3+水解程度弱,PH偏大时则_____________________________________。
(5)采取减压蒸发的原因是___________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com