
分析 (1)HClO的酸性小于碳酸,NaClO和二氧化碳、水反应生成次氯酸和碳酸氢钠;HClO不稳定,易分解生成HCl和氧气;
(2)次氯酸钠和浓盐酸发生氧化还原反应生成氯气,氯气有毒.
解答 解:(1)HClO的酸性小于碳酸,NaClO和二氧化碳、水反应生成次氯酸和碳酸氢钠,方程式为NaClO+CO2+H2O═HClO+NaHCO3;
HClO不稳定,易分解生成HCl和氧气,方程式为:2HClO$\frac{\underline{\;光照\;}}{\;}$2HCl+O2↑,
故答案为:NaClO+CO2+H2O═HClO+NaHCO3;2HClO$\frac{\underline{\;光照\;}}{\;}$2HCl+O2↑;
(2)酸性条件下,次氯酸钠和浓盐酸发生氧化还原反应生成氯气,氯气有毒,离子方程式为ClO-+Cl-+2H+═Cl2↑+H2O,
故答案为:ClO-+Cl-+2H+═Cl2↑+H2O.
点评 本题以次氯酸钠为载体考查离子方程式、化学方程式的书写,明确物质的性质及离子方程式书写规则即可解答,题目难度不大.


科目:高中化学 来源: 题型:解答题
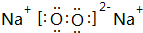 ,其中含有的化学键为离子键和共价键;
,其中含有的化学键为离子键和共价键;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 煤的液化和气化都是化学变化 | |
| B. | 硝化反应和酯化反应都属于取代反应 | |
| C. | 石油的分馏和裂化都是化学反应 | |
| D. | 乙烯与溴和水的反应都属于加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1s | B. | 2.5s | C. | 5s | D. | 10s |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
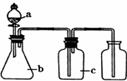 如图各相应一起中加入的试剂,可用于制取、净化、收集的气体是( )
如图各相应一起中加入的试剂,可用于制取、净化、收集的气体是( ) | 选项 | 气体 | a | b | c |
| A | H2 | 稀硫酸 | 锌粒 | 浓硫酸 |
| B | Cl2 | 浓盐酸 | 高锰酸钾 | 浓硫酸 |
| C | C2H2 | 饱和食盐水 | 电石 | 硫酸铜溶液 |
| D | O2 | 过氧化氢溶液 | 二氧化锰 | 碱石灰 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .W、X、Y的离子半径由大到小的顺序为S2->O2->Al3+(用离子符号回答)
.W、X、Y的离子半径由大到小的顺序为S2->O2->Al3+(用离子符号回答)查看答案和解析>>
科目:高中化学 来源: 题型:解答题
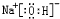 、
、 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
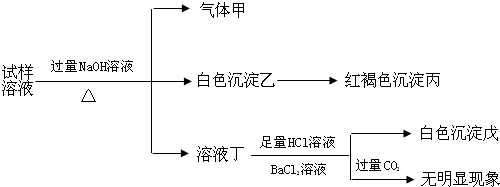
| A. | 试样中肯定有NH4+、SO42-和Fe2+ | |
| B. | 试样中一定没有Al3+ | |
| C. | 若气体甲在标准状况下体积为0.448L,沉淀丙和沉淀戊分别为1.07g和4.66g,则可判断溶液中还有Cl- | |
| D. | 该盐工业上可以用作净水剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 )中加入金属Ga,得到的盐是一种新型气体发生剂,常用于汽车安全气囊.
)中加入金属Ga,得到的盐是一种新型气体发生剂,常用于汽车安全气囊.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com