
【题目】茉莉酸甲酯的一种合成路线如下:

(1) C中含氧官能团名称为________。
(2) D→E的反应类型为________。
(3) 已知A、B的分子式依次为C6H10O4、C12H18O4,A中不含甲基,写出B的结构简式:________。
(4) D的一种同分异构体同时满足下列条件,写出该同分异构体的结构简式:________。
①分子中含有苯环,能与FeCl3溶液发生显色反应;
②碱性条件水解生成两种产物,酸化后两种分子中均只有3种不同化学环境的氢。
(5) 写出以 和CH2(COOCH3)2为原料制备
和CH2(COOCH3)2为原料制备 的合成路线流程图(无机试剂和乙醇任用,合成路线流程图示例见本题题干)_______。
的合成路线流程图(无机试剂和乙醇任用,合成路线流程图示例见本题题干)_______。
【答案】羰基和酯基 消去反应 ![]()


【解析】
(1)由结构可知C中含氧官能团为:酯基、羰基;
(2)对比D、E的结构,可知D分子中脱去1分子HCOOCH2CH=CH2形成碳碳双键得到E;
(3)A、B的分子式依次为C6H10O4、C12H18O4,A中不含甲基,结合C的结构,可知A为HOOC(CH2)4COOH、B为![]() ;
;
(4)D的一种同分异构体同时满足下列条件:①分子中含有苯环,能与FeCl3溶液发生显色反应,说明含有酚羟基;②碱性条件水解生成两种产物,说明还含有酯基,且酸化后两种分子中均只有3种不同化学环境的氢;
(5)由E→F→G转化可知, 可由
可由 加热得到,而
加热得到,而![]() 与CH2(COOCH3)2加成得到
与CH2(COOCH3)2加成得到 ,
,![]() 与氢气发生加成反应得到
与氢气发生加成反应得到 ,然后发生催化氧化得到
,然后发生催化氧化得到 ,最后发生消去反应得到
,最后发生消去反应得到![]() 。
。
由上述分析可知:A为HOOC(CH2)4COOH;B为![]() 。
。
(1)由C结构简式![]() 可知C中含氧官能团为:酯基、羰基;
可知C中含氧官能团为:酯基、羰基;
(2)对比D、E的结构,可知D分子中脱去1分子HCOOCH2CH=CH2形成碳碳双键得到E,故D生成E的反应属于消去反应;
(3)A、B的分子式依次为C6H10O4、C12H18O4,A中不含甲基,结合C的结构,可知A为HOOC(CH2)4COOH、B为![]() ;
;
(4)D的一种同分异构体同时满足下列条件:①分子中含有苯环,能与FeCl3溶液发生显色反应,说明含有酚羟基;②碱性条件水解生成两种产物,说明还含有酯基,且酸化后两种分子中均只有3种不同化学环境的氢,符合条件的同分异构体为: ;
;
(5) 与H2在Ni催化下发生加成反应产生
与H2在Ni催化下发生加成反应产生 ,
, 与O2在Cu催化下发生氧化反应产生
与O2在Cu催化下发生氧化反应产生 ,
, 与NaOH的乙醇溶液发生消去反应产生
与NaOH的乙醇溶液发生消去反应产生![]() ,
,![]() 再与CH2(COOCH3)2发生加成反应产生
再与CH2(COOCH3)2发生加成反应产生 ,该物质在高温下反应产生
,该物质在高温下反应产生 ,故合成路线流程图为:
,故合成路线流程图为: 。
。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
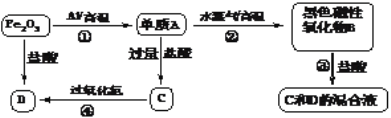
【题目】已知A、B、C、D四种物质均含有铁元素,彼此转化关系如下:
请回答:
(1)反应①称为铝热反应(属于置换反应),写出该反应的化学方程式:__、其中Al作__剂。
(2)反应④的离子方程式为:__。
(3)新配制的C溶液中应加入__,以防止其转化为D。检验D溶液中阳离子的常用试剂是__(填化学式),实验现象为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 粗铜电解精炼时,粗铜、纯铜依次分别作阴极、阳极
B. 5.6 g Fe在足量Cl2中充分燃烧,转移电子的数目为0.2×6.02×1023
C. 室温下,稀释0.1 mol/L NH4Cl溶液,溶液中 增大
增大
D. 向BaCO3、BaSO4的饱和溶液中加入少量BaCl2,溶液中 减小
减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NVCO{化学式可表示为(NH4)a[(VO)b(CO3)c(OH)d]·10H2O}能用于制取VO2,实验室可由V2O5、N2H4·2HCl、NH4HCO3为原料制备NVCO。
(1)原料NH4HCO3中HCO3-水解的离子方程式为____________。
(2) N2H4·2HCl是N2H4的盐酸盐。已知N2H4在水中的电离方式与NH3相似,25 ℃时,K1=9.55×10-7。该温度下,反应N2H4+H+![]() N2H5+的平衡常数K=________(填数值)。
N2H5+的平衡常数K=________(填数值)。
(3)为确定NVCO的组成,进行如下实验:
①称取2.130 g样品与足量NaOH充分反应,生成NH3 0.224 L(已换算成标准状况下)。
②另取一定量样品在氮气氛中加热,样品的固体残留率(固体样品的剩余质量/固体样品的起始质量×100%)随温度的变化如下图所示(分解过程中各元素的化合价不变)。

根据以上实验数据计算确定NVCO的化学式(写出计算过程)________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】影响化学反应速率的因素很多,某课外兴趣小组用实验的方法进行探究。
实验一:取等物质的量浓度等体积H2O2溶液分别进行下列实验,实验报告如下表所示。

序号 | 条件 | 现象 | 结论 | |
温度/℃ | 催化剂 | |||
1 | 40 | FeCl3溶液 | ||
2 | 20 | FeCl3溶液 | ||
3 | 20 | MnO2 | ||
4 | 20 | 无 | ||
(1)实验1、2的目的是研究__________因素对H2O2分解速率的影响。
(2)实验1对应的化学方程式为___________________________。
实验二:经研究知Cu2+对H2O2分解也具有催化作用,为比较Fe3+和Cu2+对H2O2分解的催化效果,该小组的同学分别设计了如图所示的实验。可通过观察_________得出结论。 有同学提出将FeCl3改为Fe2(SO4)3更为合理,其理由是____________________。
实验三:已知在高锰酸钾(KMnO4)酸性溶液和草酸(H2C2O4)溶液反应时,发现开始一段时间,反应速率较慢,溶液褪色不明显,但不久突然褪色,反应速率明显加快。
(1)写出硫酸酸化的高锰酸钾溶液和草酸溶液反应的化学方程式____________
(2)针对上述实验现象,某同学认为KMnO4与H2C2O4反应是放热反应,导致溶液温度升高,反应速率加快。从影响化学反应速率的因素看,你的猜想还可能是______。
(3)若用实验证明你的猜想/span>,除酸性高锰酸钾溶液、草酸溶液试剂外,还需要选择的试剂最合理的是__________。
A、硫酸钾 B、硫酸锰 C、水 D、氯化锰
(4)若实验过程中将2.0mL0.10mol/LH2C2O4溶液与4.0mL0.010mol/L酸性KMnO4溶液混合(忽略溶液混合后体积的变化),测得溶液的褪色时间为40s,这段时间内平均反应速率v(KMnO4)=__________mol·L-1·min-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某反应由两步反应A![]() B
B![]() C构成,它的反应能量曲线如图所示(E1、E2、E3、E4表示活化能)。下列有关叙述不正确的是( )
C构成,它的反应能量曲线如图所示(E1、E2、E3、E4表示活化能)。下列有关叙述不正确的是( )

A. A→C的反应为放热反应 B. 稳定性C>A>B.
C. A→C的反应中,△H=(E2+E4)-(E1+E3) D. 加入催化剂不会改变反应的焓变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知2SO2(g)+O2(g)![]() 2SO3(g) ΔH =-197 kJ·mol-1。在25 ℃时,向恒压密闭容器中通入2 mol SO2和1 mol O2,达到平衡时放出热量a1;若25 ℃时,在此恒压密闭容器中只通入1 mol SO2和0.5 mol O2,达到平衡时放出热量a2。则下列关系正确的是( )
2SO3(g) ΔH =-197 kJ·mol-1。在25 ℃时,向恒压密闭容器中通入2 mol SO2和1 mol O2,达到平衡时放出热量a1;若25 ℃时,在此恒压密闭容器中只通入1 mol SO2和0.5 mol O2,达到平衡时放出热量a2。则下列关系正确的是( )
A. 2a2=a1=197 kJ B. 2a2<a1<197 kJ
C. a2>a1>197 kJ D. 197 kJ>a1=2a2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下为氨气部分用途
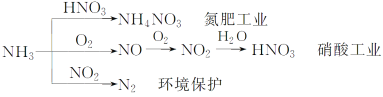
下列有关叙述错误的是
A.NH4NO3是常用化肥
B.在硝酸工业中氮元素的化合价变化情况:-3→+2→+4→+5
C.NH3和NO2在一定条件下发生氧化还原反应,其化学方程式:8NH3+6NO2![]() 7N2+12H2O
7N2+12H2O
D.NH3在氮肥工业中氮元素被还原,而在硝酸工业中氮元素被氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,请回答有关问题:
ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
2 | ① | ② | ||||||
3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
4 | ⑨ | ⑩ |
(1)⑤和⑧的元素符号是_______和_______。
(2)元素①的最高价氧化物的电子式是_________________,元素①的某种烃A分子的球棍模型为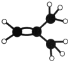 ,则A分子中最多有______个原子共平面。
,则A分子中最多有______个原子共平面。
(3)元素⑦和⑨的最高价氧化物的水化物反应的离子方程式为:____________________。
(4)请用化学方程式表示比较⑦、⑩单质氧化性的强弱:_________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com