
右图是关于反应A2(g)+3B2(g)  2C(g)(正反应为放热反应)
2C(g)(正反应为放热反应)
的平衡移动图形,影响平衡移动的原因是
A.升高温度,同时加压
B.降低温度,同时减压
C.增大反应物浓度,同时使用适宜的催化剂
D.增大反应物浓度,同时减小生成物浓度
【知识点】化学平衡移动 G1 G2 G3
【答案解析】D 解析:A、升高温度,同时加压,正逆反应速率都增大,升高温度,使平衡向逆反应移动,增大压强,使平衡向正反应移动,平衡可能不移动,可能向正反应移动,可能向逆反应移动故A错误;、降低温度,同时减压正逆反应速率都降低,降低温度,使平衡向正反应移动,减小压强,使平衡向逆反应移动,平衡可能不移动,可能向正反应移动,可能向逆反应移动,故B错误;增大反应物浓度,同时使用催化剂,正逆反应速率都增大,但正反应速率增大更多,平衡向正反应移动,故C错误;D、增大反应物浓度,同时减小生成物浓度,瞬间正反应速率增大,逆反应速率减小,平衡向正反应移动,故D正确;
【知识点】本题考查了外界条件对化学反应速率和平衡的影响、平衡移动图象,难度较大,明确温度、压强、浓度变化引起化学反应速率变化是解本题的关键.


科目:高中化学 来源: 题型:
在一定条件下,二氧化硫和氧气发生如下反应:
2SO2(g)+O2 (g)⇌2SO3(g)(△H<0)
(1)写出该反应的化学平衡常数表达式K= .
(2)降低温度,该反应K值 ,二氧化硫转化率 ,化学反应速率 (以上均填增大、减小或不变).
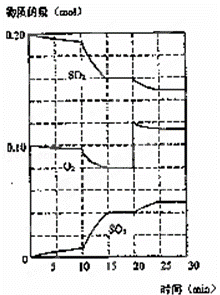
(3)600℃时,在一密闭容器中,将二氧化硫和氧气混合,反应过程中SO2、O2、SO3物质的量变化如图,反应处于平衡状态的时间是 .
(4)据图判断,反应进行至20min时,曲线发生变化的原因是 (用文字表达)
(5)10min到15min的曲线变化的原因可能是 (填写编号).
a.加了催化剂 b.缩小容器体积 c.降低温度 d.增加SO3的物质的量.
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是 ( )。
A.将AlCl3溶液和Al2(SO4)3溶液分别加热、蒸干、灼烧,所得固体成分相同
B.配制FeSO4溶液时,将FeSO4固体溶于稀盐酸中,然后稀释至所需浓度
C.用加热的方法可以除去KCl溶液中的Fe3+
D.洗涤油污常用热的碳酸钠溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
工业合成氨与制备硝酸一般可连续生产,流程如下:
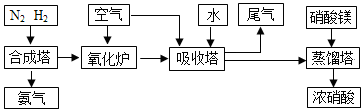
(1)简述原料气N2、H2的 。(2)下列可以代替硝酸镁加入到蒸馏塔中的是:
A.浓硫酸 B.氯化钙 C.氯化镁 D.生石灰
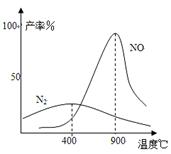
(3)氨气和氧气145℃就开始反应,在不同温度和催化剂时生成不同产物(如图所示):
4NH3+5O2 4NO+6H2O K1=1×1053(900℃)
4NO+6H2O K1=1×1053(900℃)
4NH3+3O2 2N2+6H2O K2=1×1067(900℃)
2N2+6H2O K2=1×1067(900℃)
温度较低时以生成 为主,温度高于900℃时,
NO产率下降的原因 。
吸收塔中需要补充空气的原因 。
(4)尾气处理时小型化工厂常用尿素作为氮氧化物的吸收剂,此法运行费用低,吸收效果好,不产生二次污染,吸收后尾气中NO和NO2的去除率高达99.95%。其主要的反应为氮氧化物混合气与水反应生成亚硝酸,亚硝酸再与尿素[CO(NH2)2]反应生成CO2 和N2,请写出有关反应化学方程式:
, 。
查看答案和解析>>
科目:高中化学 来源: 题型:
FeCl3(aq)与KSCN(aq)混合时存在下列平衡:
Fe3+(aq)+SCN-(aq) 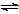 Fe(SCN)2+(aq)。已知平衡时,物质的量浓度c[Fe(SCN)2+]与温度T的关系如图所示,则下列说法正确的是
Fe(SCN)2+(aq)。已知平衡时,物质的量浓度c[Fe(SCN)2+]与温度T的关系如图所示,则下列说法正确的是
A.FeCl3(aq)与KSCN(aq)反应的热化学反应方程式为
Fe3+(aq)+SCN—(aq) 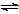 Fe(SCN)2+(aq) ΔH >0
Fe(SCN)2+(aq) ΔH >0
B.温度为T1、T2时,反应的平衡常数分别为K1、K2,则K1<K2
C.反应处于D点时,一定有υ正>υ逆
D.A点与B点相比,A点的c(Fe3+)大
查看答案和解析>>
科目:高中化学 来源: 题型:
( I) 在一个容积固定不变的密闭容器中进行反应:
2X(g) + Y(g)  2Z(g) 若把2molX和1molY充入该容器时,处于状态I,达到平衡时处于状态II(如图1),则该反应的△H 0; ( 填:“< ,> ,= ”)。该反应在 (填:高温或低温)条件下能自发进行。
2Z(g) 若把2molX和1molY充入该容器时,处于状态I,达到平衡时处于状态II(如图1),则该反应的△H 0; ( 填:“< ,> ,= ”)。该反应在 (填:高温或低温)条件下能自发进行。
(II)在容积可变的密闭容器中发生反应:mA(g) + nB(g)  pC(g) ,
pC(g) ,
在一定温度和不同压强下达到平衡时,分别得到A的物质的量浓度如
下表
| 压强p/Pa | 2×105 | 5×105 | 1×106 |
| c(A)/mol·L-1 | 0.08 | 0.20 | 0.44 |
⑴当压强从2×105 Pa增加到5×105 Pa时,平衡 移动(填:向左, 向右 ,不)
⑵维持压强为2×105 Pa,当反应达到平衡状态时,体系中共有amol气体,再向体系中加入bmolB,当重新达到平衡时,体系中气体总物质的量是 mol.
⑶当压强为1×106 Pa时,此反应的平衡常数表达式: 。
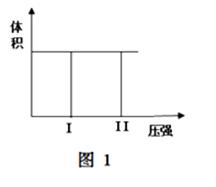
⑷其他条件相同时,在上述三个压强下分别发生该反应。2×105 Pa时,A的转化率随时间变化如下图,请在图中补充画出压强分别为5×105 Pa和1×106 Pa时,A的转化率随时间的变化曲线(请在图线上标出压强)。
查看答案和解析>>
科目:高中化学 来源: 题型:
.工业合成氨与制备硝酸一般可连续生产,流程如图所示:
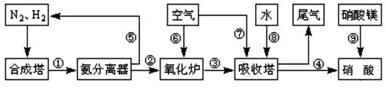
(1)工业生产时,制取氢气的一个反应为:CO+H2O(g) CO2+H2
CO2+H2
T℃时,往1L密闭容器中充入0.2mol CO和0.3mol水蒸气。反应建立平衡后,体系中c(H2)=0.12mol·L-1。该温度下此反应的平衡常数K=_____(填计算结果)。
(2)合成塔中发生反应N2(g)+3H2(g) 2NH3(g);△H<0。下表为不同温度下该反应的平衡常数。由此可推知,表中T1____573K(填“>”、“<”或“=”)。
2NH3(g);△H<0。下表为不同温度下该反应的平衡常数。由此可推知,表中T1____573K(填“>”、“<”或“=”)。
| T/℃ | T1 | 300 | T2 |
| K | 1.00×107 | 2.45×105 | 1.88×103 |
(3)N2和H2以铁作催化剂从145℃就开始反应,不同温度下NH3的产率如图所示。温度高于900℃时,NH3产率下降的原因是
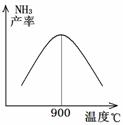
(4)硝酸厂的尾气直接排放将污染空气,目前科学家探索利用燃料气体中的甲烷等将氮氧化物还原为氮气和水,其反应机理为:
CH4(g)+4NO2=(g)=4NO(g)+CO2(g)+2H2O(g); △H=-574kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g); △H=-1160kJ·mol-1
则甲烷直接将NO2还原为N2的热化学方程式为:
(5)氨气在纯氧中燃烧,生成一种单质和水。科学家利用此原理,设计成氨气-氧气燃料电池,则通入氨气的电极碱性条件下发生反应的电极反应式为
。
查看答案和解析>>
科目:高中化学 来源: 题型:
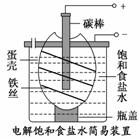
如图为电解饱和食盐水的简易装置,下列有关说法正确的是( )
A.电解一段时间后,往蛋壳中溶液中滴加几滴酚酞,呈红色
B.蛋壳表面缠绕的铁丝发生氧化反应
C.铁丝表面生成的气体能使湿润的淀粉碘化钾试纸变蓝
D.蛋壳可阻止生成的氯气与氢气、氢氧化钠溶液接触
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com