
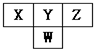
 如图是周期表中短周期的一部分.已知Y和W原子能形成两种造成酸雨的有害气体,则下列说法中不正确的是( )
如图是周期表中短周期的一部分.已知Y和W原子能形成两种造成酸雨的有害气体,则下列说法中不正确的是( )| A. | 原子半径的大小顺序是W>Y>Z | |
| B. | X的氢化物没有Z的氢化物稳定 | |
| C. | Z元素的最高价氧化物的水化物的酸性最强 | |
| D. | Y的氢化物比W的氢化物沸点高,是因为分子间存在氢键 |
分析 W、X、Y、Z都是短周期元素,根据元素在周期表中的位置知,W是第三周期元素,X、Y、Z属于第二周期元素,Y和W原子能形成两种造成酸雨的有害气体,则Y为O元素、W为S元素,可知X为N元素、Z为F元素.
A.同周期自左而右原子半径减小,同主族自上而下原子半径增大;
B.同周期自左而右元素非金属性增强,非金属性越强,氢化物越稳定;
C.F元素没有最高价含氧酸;
D.水分子之间存在氢键,而硫氢化分子之间不能形成氢键,故水的沸点较高.
解答 解:W、X、Y、Z都是短周期元素,根据元素在周期表中的位置知,W是第三周期元素,X、Y、Z属于第二周期元素,Y和W原子能形成两种造成酸雨的有害气体,则Y为O元素、W为S元素,可知X为N元素、Z为F元素.
A.同周期自左而右原子半径减小,同主族自上而下原子半径增大,故原子半径:W>Y>Z,故A正确;
B.同周期自左而右元素非金属性增强,非金属性越强,氢化物越稳定,故Z的氢化物比X的氢化物稳定,故B正确;
C.F元素没有最高价含氧酸,故C错误;
D.水分子之间存在氢键,而硫氢化分子之间不能形成氢键,故水的沸点较高,故D正确,
故选:C.
点评 本题考查结构位置性质关系、元素周期律等,比较基础,注意整体把握元素周期表的结构与元素周期律.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 0.5mo1H20含有的原子数目为1.5NA | |
| B. | 3.6g石墨和C60的混合物中,含有的碳原子数为0.3NA | |
| C. | 含有4.6g钠元素的过氧化钠和氯化钠的混合物中.所含离子总数为0.3NA | |
| D. | 0.5NA个氯分子的物质的量是0.5mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验方法 | 实验方案 | 测量数据 | |
| A. | 量气法 | 将样品与盐酸反应,气体通过排水量气装置量气 | 排水体积 |
| B. | 量气法 | 将样品与盐酸反应,生成的气体全部被碱石灰吸收 | 碱石灰增重 |
| C. | 重量法 | 样品放入烧瓶中,置于电子天平上,加入足量盐酸 | 减轻的质量 |
| D. | 滴定法 | 将样品配成100mL溶液,取10mL加入酚酞,用标准盐酸确定 | 消耗盐酸的体积 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;V原子的结构示意图
;V原子的结构示意图 ;Z的氢化物结构式为
;Z的氢化物结构式为 ;写出U元素在周期表中的位置第三周期第VIA族N2W2中含有的化学键的种类离子键、共价键
;写出U元素在周期表中的位置第三周期第VIA族N2W2中含有的化学键的种类离子键、共价键查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图所示.已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的电负性在同周期主族元素中最大.
W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图所示.已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的电负性在同周期主族元素中最大.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 通入足量溴水中 | B. | 在空气中燃烧 | ||
| C. | 通入酸性高锰酸钾溶液中 | D. | 通入液溴中 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 将乙烯和乙炔气体分别通入溴的四氯化碳溶液中前者褪色,后者不褪色 | |
| B. | 鉴别乙烷和乙炔可将二者分别通入酸性高锰酸钾溶液中 | |
| C. | 苯能使溴水褪色是因为二者反应生成了溴苯 | |
| D. | 苯不能使酸性高锰酸钾溶液褪色,而甲苯则能,因甲苯被氧化为苯甲酸 | |
| E. | 工业上制备氯乙烯可用乙炔在一定条件下与氯化氢发生取代反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子总数 | B. | 总质量 | C. | 原子总数 | D. | 密度 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4 L氦气与22.4 L氟气所含原子数均为2NA | |
| B. | 12g石墨烯(单层石墨)中含有六元环的个数为0.5NA | |
| C. | 25℃时pH=13的NaOH溶液中含有OH一的数目为0.1 N0 | |
| D. | 1L1 mol/L Na2CO3溶液中含阴离子数目小于0.1mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com