
分析 (1)酸或碱抑制水电离,含有弱离子的盐促进水电离,酸中氢离子浓度越大或碱中氢氧根离子浓度越大,其抑制水电离程度越大;
(2)化学式中铵根离子个数相等的强电解质中,醋酸根离子促进铵根离子水解,氢离子抑制铵根离子水解,一水合氨是弱电解质,其电离程度较小;
(3)将③和④按体积比1:2混合后,溶液中的溶质是等物质的量浓度的NH4Cl、NaCl、NH3.H2O,一水合氨的电离程度大于铵根离子水解程度,溶液呈碱性,再结合物料守恒判断;
(4)在t℃时将pH=11的NaOH溶液中c(OH-)=$\frac{1{0}^{-13}}{1{0}^{-11}}$mol/L=0.01mol/L,pH=1的H2SO4溶液中c(H+)=0.1mol/L,若所得混合溶液的pH=2,则混合溶液中c(H+)=$\frac{0.1mol/L×bL-0.01mol/L×aL}{(a+b)L}$=0.01mol/L,据此计算a、b之比;
(5)同体积、同物质的量浓度的①硫酸和②醋酸溶液,溶质的物质的量相等,而等物质的量的①硫酸和②醋酸,硫酸是二元强酸中和碱的能力强.
解答 解:(1)酸或碱抑制水电离,含有弱离子的盐促进水电离,酸中氢离子浓度越大或碱中氢氧根离子浓度越大,其抑制水电离程度越大,等浓度的这几种溶液中,NH4Cl促进水电离,H2SO4中氢离子浓度是0.2mol/L、醋酸中氢离子浓度小于0.1mol/L、NaOH中氢氧根离子浓度为0.1mol/L,所以①.②.③.④四种溶液中由水电离出的H+浓度由大到小的顺序是④②③①,故答案为:④②③①;
(2)化学式中铵根离子个数相等的强电解质中,醋酸根离子促进铵根离子水解,氢离子抑制铵根离子水解,一水合氨是弱电解质,其电离程度较小,所以等浓度的这几种溶液中,铵根离子浓度大小顺序是⑥④⑤⑦,故答案为:⑥④⑤⑦;
(3)将③和④按体积比1:2混合后,溶液中的溶质是等物质的量浓度的NH4Cl、NaCl、NH3.H2O,一水合氨的电离程度大于铵根离子水解程度,溶液呈碱性,溶液中氢离子和氢氧根离子浓度都较小,结合物料守恒得,溶液中离子浓度大小顺序是c(Cl-)>c(NH4+)>c(Na+)>c(OH-)>c(H+),
故答案为:c(Cl-)>c(NH4+)>c(Na+)>c(OH-)>c(H+);
(4)在t℃时将pH=11的NaOH溶液中c(OH-)=$\frac{1{0}^{-13}}{1{0}^{-11}}$mol/L=0.01mol/L,pH=1的H2SO4溶液中c(H+)=0.1mol/L,若所得混合溶液的pH=2,则混合溶液中c(H+)=$\frac{0.1mol/L×bL-0.01mol/L×aL}{(a+b)L}$=0.01mol/L,a:b=9:2,
故答案为:9:2;
(5)同体积、同物质的量浓度的①硫酸和②醋酸溶液,溶质的物质的量相等,而等物质的量的①硫酸和②醋酸,硫酸是二元强酸中和碱的能力强,所以所需NaOH体积大小关系为①>②,故答案为:>.
点评 本题考查溶液离子浓度大小的比较以及盐类的水解和弱电解质的电离等问题,题目难度较大,注意把握影响盐类水解以及电解质的电离的因素.


 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ω=$\frac{35a}{22.4Vρ}$×100% | |
| B. | C=$\frac{1000a}{22.4V}$mol/L | |
| C. | 可用装置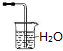 吸收氨气 吸收氨气 | |
| D. | 上述溶液中再加入VmL水,所得溶液的质量分数大于0.5ω |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 完成下列方程式
完成下列方程式查看答案和解析>>
科目:高中化学 来源: 题型:选择题
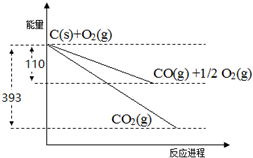
| A. | 等物质的量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多 | |
| B. | 由单质A转化为单质B时△H=+119 kJ/mol 可知单质B比单质A稳定 | |
| C. | 稀溶液中:H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ/mol,若将含0.5mol H2SO4的浓硫酸与含l mol NaOH的溶液混合,放出的热量大于57.3kJ | |
| D. | 在101kPa时,H2燃烧的热化学方程式为2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ/mol,则H2在101kPa时的燃烧热为571.6kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 所含铁元素化合价降低,被氧化 | |
| B. | 160gFe2O3失去6mol电子 | |
| C. | Fe2O3→Fe的过程需要加还原剂才能实现 | |
| D. | 是还原产物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2H++2e-═H2↑ | B. | 2H2O+O2+4e-═4OH- | ||
| C. | Fe-2e-═Fe2+ | D. | 4OH--4e-═2H2O+O2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe2O3可以做油漆的颜料 | B. | Al2O3可用作耐火材料 | ||
| C. | 铝合金比纯铝的熔点更高 | D. | 赤铁矿可用作炼铁的原料 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com