
| A. | CH4(g)+2O2(g)═CO2(g)+2H2O(l);△H=+890.3 kJ•mol-1 | |
| B. | CH4(g)+2O2(g)═CO2(g)+2H2O(l);△H=-890.3 kJ•mol-1 | |
| C. | CH4(g)+2O2(g)═CO2(g)+2H2O(g);△H=-890.3 kJ | |
| D. | 2H2(g)+O2(g)═2H2O(l);△H=-285.8 kJ |
分析 A.甲烷燃烧为放热反应,焓变应该为负值;
B.根据“1mol CH4完全燃烧生成液态水和CO2”分析;
C.生成水的状态应该为液态;
D.焓变与化学计量数成正比,2mol氢气完全燃烧放出热量应该为285.8 kJ×2=571.6kJ.
解答 解:A.甲烷的燃烧为放热反应,焓变△H=-890.3 kJ•mol-1,故A错误;
B.1mol CH4完全燃烧生成液态水和CO2,该反应的热化学方程式为:CH4(g)+2O2(g)═CO2(g)+2H2O(l);△H=-890.3 kJ•mol-1,故B正确;
C.生成水的状态错误,应该为液态水,故C错误;
D.1molH2完全燃烧生成液态水,放出285.8kJ的热量,则2mol氢气完全燃烧放出热量应该为:285.8 kJ×2=571.6kJ,故D错误;
故选B.
点评 本题考查热化学方程式,题目难度不大,明确反应热与焓变的关系为解答关键,注意熟练掌握热化学方程式的书写原则,试题侧重基础知识的考查,有利于提高学生的灵活应用能力.


 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案科目:高中化学 来源: 题型:多选题
| A. | c(X2)=0.1mol•L-1 | B. | c(Y2)=0.3mol•L-1 | C. | c(X2)=0.2mol•L-1 | D. | c(Z)=0.3mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
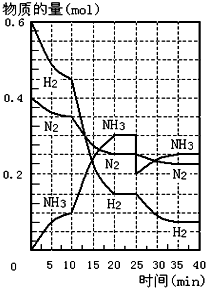 500℃、20MPa时,将H2和N2置于一容积为2L的密闭容器中发生反应.反应过程中H2、N2和NH3的物质的量变化如图所示,根据题意完成下列各题:
500℃、20MPa时,将H2和N2置于一容积为2L的密闭容器中发生反应.反应过程中H2、N2和NH3的物质的量变化如图所示,根据题意完成下列各题:查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 密度/(g•cm-3) | 熔点/℃ | 沸点/℃ | |
| 四氯化锡 | 2.2 | -33 | 114 |
| 金属锡 | 5.77 | 231 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化学反应过程中,一定有化学键的断裂和形成 | |
| B. | 日常生活中的废旧电池会污染环境,所以应集中填埋处理 | |
| C. | 化学反应过程中,分子的种类和数目一定发生改变 | |
| D. | 放热反应的反应速率,一定比吸热反应的反应速率快 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
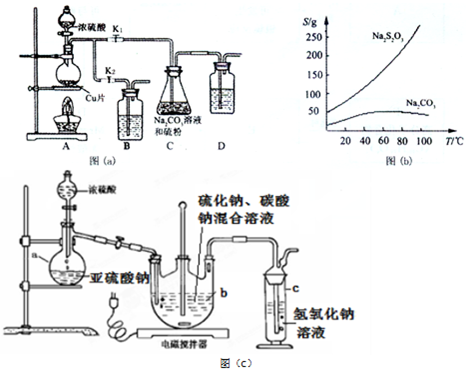
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
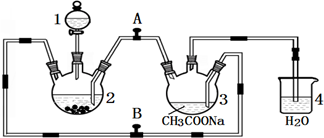
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 离子 | SO42- | SO32- | NO3- | NO2- | Cl- |
| c/(mol•L-1) | 8.35×10-4 | 6.87×10-6 | 1.5×10-4 | 1.2×10-5 | 3.4×10-3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2O2 Al2(SO4)3 MgCl2 K2CO3 | B. | BaCl2 Na2SO4 (NH4)SO4 KOH | ||
| C. | AgNO3 NaCl KCl CuCl2 | D. | Fe2(SO4)3 K2CO3 KHSO4 NH4Cl |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com