
 氨、硫、氯及其化合物对环境有着重要的影响,在化工生产和日常生活中的用途也十分广泛,如用做漂白剂、沉淀剂、农药、化肥等.
氨、硫、氯及其化合物对环境有着重要的影响,在化工生产和日常生活中的用途也十分广泛,如用做漂白剂、沉淀剂、农药、化肥等.分析 (1)△H=反应物的键能之和-生成物的键能之和;
(2)等体积SO2和Cl2 同时缓慢通水中发生Cl2+SO2+2H2O=H2SO4+2HCl,结合方程式计算;
(3)NH4HSO3溶液铵根离子水解呈酸性,抑制亚硫酸氢根离子的电离;
(4)阴极生成氢气,同时生成OH-,与NaHSO3溶液反应生成Na2SO3;阳极生成氧气,同时生成H+,与NaHSO3反应生成SO2;
(5)氨水溶液呈碱性,与MgCl2 溶液反应生成氢氧化镁沉淀,根据Ksp计算生成沉淀时的c(OH-),结合氨水的电离平衡常数计算需要氨气的体积.
解答 解:1)△H=反应物的键能之和-生成物的键能之和=(946kJ.mol-1)+3×(436kJ.mol -1)-6×(391kJ.mol-1)=-92kJ.mol-1,
故答案为:-92;
(2)n(SO2)=n(Cl2)=$\frac{0.56L}{22.4L/mol}$=0.025mol,
等体积SO2和Cl2 同时缓慢通水中发生Cl2+SO2+2H2O=H2SO4+2HCl,则生成n(H+)=0.025mol×4=0.1mol,c(H+)=$\frac{0.1mol}{1.0L}$=0.1mol/L,
pH=-lg0.1=1,
故答案为:1;
(3)NH4HSO3溶液铵根离子水解呈酸性,抑制亚硫酸氢根离子的电离,则阴离子的电离程度较小的是NH4HSO3,
故答案为:NH4HSO3;铵根离子水解呈酸性,抑制亚硫酸氢根离子的电离;
(4)阴极生成氢气,同时生成OH-,与NaHSO3溶液反应生成Na2SO3,阳极生成氧气,同时生成H+,与NaHSO3反应生成SO2,
故答案为:Na2SO3;O2、SO2;
(5)①氨水溶液呈碱性,与MgCl2 溶液反应生成氢氧化镁沉淀,反应的离子方程式为Mg2++2NH3•H2O=Mg(OH)2↓+2NH4+,
故答案为:Mg2++2NH3•H2O=Mg(OH)2↓+2NH4+;
②开始有白色沉淀出现时,c(OH-)=$\sqrt{\frac{1.8×1{0}^{-11}}{2.0×1{0}^{-4}}}$mol/L=3×l0-4mol/L,
结合氨水的电离平衡常数=$\frac{c(N{{H}_{4}}^{+})•c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$=$\frac{{c}^{2}(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$=1.8×l0-5,c(NH3.H2O)=5×l0-3mol/L,
未电离前c(NH3.H2O)=5×l0-3mol/L+3×l0-4mol/L=5.3×l0-3mol/L,
n(NH3)=5.3×l0-3mol,
通入氨气的体积=5.3×l0-3mol/L×22.4L/mol=0.11872L=118.72mL,
故答案为:118.72.
点评 本题考查较为综合,涉及化学反应与能量变化、pH的计算、盐类的水解以及难溶电解质的溶解平衡等问题,为高考常见题型,侧重于学生的分析、计算能力的考查,注意相关知识的积累,难度中等.


 寒假大串联黄山书社系列答案
寒假大串联黄山书社系列答案科目:高中化学 来源: 题型:选择题
| A. | 检查装置的气密性--制取气体、验证气体的性质等与气体有关的实验操作 | |
| B. | 检查是否漏水--滴定管、容量瓶、分液漏斗等的使用 | |
| C. | 验纯--点燃可燃性气体 | |
| D. | 湿润--用石蕊试纸、碘化钾淀粉试纸和pH 试纸检验或验证某些气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 25℃时,pH=11 NaOH溶液和pH=3 CH3COOH混合,若溶液显酸性,则所得溶液中离子浓度可能为c(CH3COO-)>c(H+)>c(Na+)>c(OH-) | |
| B. | 取c(H+)=0.01mol/L的盐酸和醋酸各100mL,分别稀释2倍后,再分别加入0.03g锌粉,在相同条件下充分反应,醋酸与锌反应的速率大 | |
| C. | 含等物质的量的NaHC2O4和Na2C2O4的溶液中存在:2c(Na+)=3[c(HC2O4-)+c(C2O42-)+c(H2C2O4)] | |
| D. | 25℃时,某溶液中由水电离出的c(H+)=10-amol/L,若a>7时,该溶液pH一定为14-a |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
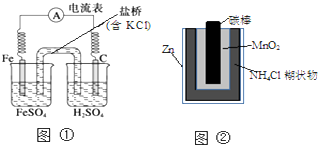
| A. | 图①中正极附近溶液pH降低 | |
| B. | 图②正极反应是2MnO2(s)+H2O(l)+2e-=Mn2O3(s)+2OH-(aq) | |
| C. | 图①中电子由Fe流向石墨,盐桥中的Cl-移向FeSO4溶液 | |
| D. | Zn-MnO2干电池自放电腐蚀主要是由MnO2的氧化作用引起的 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 十五种 | B. | 十六种 | C. | 十七种 | D. | 十八种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可以收集到氯气$\frac{22.4b}{2{N}_{A}}$L | B. | 反应后Cl-数目为bc-d | ||
| C. | NA可表示为$\frac{87d}{2a}$ | D. | 反应后溶液中的H+数目为bc-2d |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有① | B. | 只有②③⑤ | C. | 只有⑤ | D. | 全部 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com