
下列说法中,正确的是
A.已知25℃时NH4CN水溶液显碱性,则25℃时的电离常数K(NH3·H2O)>K(HCN)
B.25℃时,Mg(OH)2固体在20 mL0.01 mol·L-1氨水中的Ksp比在20 mL0.01 mol·L-1NH4Cl溶液中的Ksp小
C.pH试纸测得新制氯水的pH为4.5
D.FeCl3溶液和Fe2(SO4)3溶液加热蒸干、灼烧都得到Fe2O3
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2013-2014学年广东省惠州市高三4月模拟考试理综化学试卷(解析版) 题型:选择题
下列说法不正确的是
A.NaHCO3和Na2CO3混合溶液中:c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-)
B.常温下,浓度均为0.1 mol·L-1下列各溶液的pH:NaOH>Na2CO3> NaHCO3> NH4Cl
C.向冰醋酸中逐滴加水,醋酸的电离程度、pH均先增大后减小
D.常温下,pH=1的稀硫酸与醋酸溶液中,c (SO42-)与c(CH3COO-)之比为2∶1
查看答案和解析>>
科目:高中化学 来源:2013-2014学年广东省十校联考高三下学期理综化学试卷(解析版) 题型:选择题
下列微粒在水溶液中能大量共存的是
A.Fe3+、H+、I-、Na+
B.Al3+、Na+、AlO2-、SO42-
C.K+、NH4+、H+、CO32—
D.Cu2+、SO42—、Al3+、Cl—
查看答案和解析>>
科目:高中化学 来源:2013-2014学年山东省文登市高三第三次统考理科综合化学试卷(解析版) 题型:选择题
下列图象描述正确的是

A.图①表示体积和PH值均相同的稀硫酸和醋酸,和足量的镁反应生成H2量的关系
B.图②表示向氨水中滴加醋酸,溶液导电性变化的关系
C.图③表示2SO2(g)+O2(g) 2SO3(g)反应中,SO2和O2反应速率大小关系
2SO3(g)反应中,SO2和O2反应速率大小关系
D.图④表示向H2S中通入Cl2时,溶液的pH大小变化关系
查看答案和解析>>
科目:高中化学 来源:2013-2014学年山东省德州市高三4月模拟考试(二模)理综化学试卷(解析版) 题型:填空题
天冬酰胺(结构如图)在芦笋中含量丰富,具有提高身体免疫力的功效。
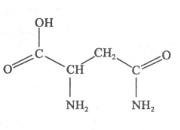
(1)天冬酰胺所含元素中, (填元素名称)元素基态原子核外未成对电子数最多,天冬酰胺中碳原子的杂化轨道类型有 种。
(2)H2S和H2Se的参数对比见表。
化学式 | 键长/nm | 键角 | 沸点/℃ |
H2S | 1.34 | 92.3o | 一60.75 |
H2Se | 1.47 | 91.0o | 一41.50 |
①H2Se的晶体类型为 ,含有的共价键类型为 。
②H2S的键角大于H2Se的原因可能为 。
(3)已知钼(Mo)位于第五周期VIB族,钼、铬、锰的部分电离能如下表所示
编号 | I5/kJ·mol-1 | I6/kJ·mol-1 | I7/kJ·mol-1 | I8/kJ·mol-1 |
A | 6990 | 9220 | 11500 | 18770 |
B | 6702 | 8745 | 15455 | 17820 |
C | 5257 | 6641 | 12125 | 13860 |
A是 (填元素符号),B的价电子排布式为 。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年山东省德州市高三4月模拟考试(二模)理综化学试卷(解析版) 题型:选择题
化学与社会、生产、生活密切相关。下列说法正确的是
A.碳纤维是一种新开发的材料,它属于合成有机高分子化合物
B.对“地沟油”进行分馏可得到汽油
C.漂白粉长期暴露在空气中最后会变质失效
D.氯气溶于水生成次氯酸有强氧化性,可以起到除去水中杂质和杀菌消毒作用
查看答案和解析>>
科目:高中化学 来源:2013-2014学年天津市高三年级4月考理综化学试卷(解析版) 题型:选择题
下列方程式中正确的是
A.FeCl2溶液滴加碘水:2Fe2++I2=2Fe3++2I—
B.双氧水中滴加2滴FeCl3溶液:2Fe3++H2O2=2Fe2++O2↑+2H+
C.双氧水加入稀硫酸和KI溶液: H2O2+2H++2I—= I2+ O2↑+2 H2O
D.在Mg(OH)2悬浊液中滴加氯化铵溶液:Mg(OH)2+2NH4Cl=2NH3·H2O+MgCl2
查看答案和解析>>
科目:高中化学 来源:2013-2014学年北京顺义区高三第二次统练理综化学试卷(解析版) 题型:填空题
高分子化合物G是作为锂电池中Li+迁移的介质,合成G的流程如下:
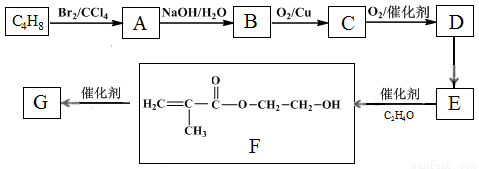
已知:①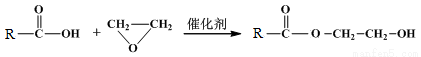
②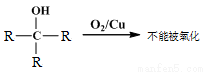
(1)B的含氧官能团名称是 。
(2)A→B的反应类型是 。
(3)C的结构简式是 。
(4)D→E反应方程式是 。
(5)G的结构简式是 。
(6)D的一种同分异构体,能发生分子内酯化反应生成五元环状化合物,该同分异构体的结构简式是 。
(7)已知: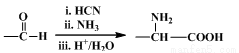
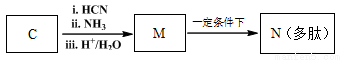
M→N的化学方程式是 。
(8)下列说法正确的是 (填字母)。
a.E有顺反异构体
b.C能发生加成、消去反应
c.M既能与酸反应,又能与碱反应
d.苯酚与 C反应能形成高分子化合物
e.含有-OH和-COOH的D的同分异构体有2种
查看答案和解析>>
科目:高中化学 来源:2013-2014学年上海市闵行区高三二模化学试卷(解析版) 题型:填空题
氢气还原氧化铜所得的红色固体可能是铜与氧化亚铜的混合物,已知Cu2O在酸性溶液中可发生自身氧化还原反应,生成Cu2+和Cu。
(1)现有8.4克氧化铜被氢气完全还原后,得到红色固体6.96克,其中含单质铜与氧化亚铜的物质的量之比是 ;
(2)若将6.96克上述混合物与足量的浓硝酸充分反应:
①生成标准状况下1.568升的气体(不考虑NO2的溶解,也不考虑NO2与N2O4的转化),则该气体的成分是 ,其物质的量之比是 ;
②把得到的溶液小心蒸发浓缩,把析出的晶体过滤,得晶体20.328g。经分析,原溶液中的Cu2+有20%残留在母液中,所得晶体的化学式为 。
(3)Cu、Cu2O和CuO组成的混合物,加入100mL 0.6mol/L HNO3溶液恰好使混合物完全溶解,同时收集到224mL NO气体(标准状况)。如原混合物中Cu的物质的量为X,求其中Cu2O、CuO的物质的量及X的取值范围(写出解题过程)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com