

分析 (1)只要能减少化石燃料等资源的运用都属于“开源节流”;
(2)①依据物质能量越高,物质越不稳定;依据图象判断石墨的燃烧热;
②可以先根据反应物和生成物书写化学方程式,根据盖斯定律计算反应的焓变,最后根据热化学方程式的书写方法来书写热化学方程式;
(3)①分析图象得到生成1mol水的焓变△H=-553.75KJ/mol,依据热化学方程式书写方法写出,注意物质聚集状态,对应量下的焓变;
②依据热化学方程式结合混合气体物质的量和放热列式计算得到二甲醚和丙烷物质的量之比.
解答 解:(1)只要能减少化石燃料等资源的运用都属于“开源节流”;
b、大力开采煤、石油和天然气,不能减少化石燃料的运用,故错误;
a、c、d能减少化石燃料的运用,故正确.
故答案为:b;
(2)①图象分析金刚石能量高于石墨,能量越低越稳定,所以说明石墨稳定,图象分析1mol石墨完全燃烧生成1mol二氧化碳放出的热量为393.5kJ,则石墨的燃烧热为△H=-393.5kJ?mol-1;
故答案为:石墨;-393.5kJ?mol-1;
②已知:①C (s,石墨)+O2(g)=CO2(g)△H1=-393.5kJ•mol-1;
②2H2(g)+O2(g)=2H2O (l)△H2=-571.6kJ•mol-1;
③2C2H2(g)+5O2(g)═4CO2(g)+2H2O (l)△H2=-2599kJ•mol-1;
2C (s,石墨)+H2(g)=C2H2(g)的反应可以根据①×2+②×$\frac{1}{2}$-③×$\frac{1}{2}$得到,
所以反应焓变△H=2×(-393.5kJ•mol-1)+(-571.6kJ•mol-1)×$\frac{1}{2}$-(-2599kJ•mol-1)×$\frac{1}{2}$=+226.7kJ•mol-1,
故答案为:2C(s,石墨)+H2(g)=C2H2(g),△H=+226.7kJ•mol-1;
(3)①图象是一定量丙烷完全燃烧生成CO2和1mol H2O(l)过程中的能量变化图,丙烷燃烧反应放热△H=-553.75KJ/mol;
丙烷完全燃烧生成CO2和1mol H2O(l)过程中的能量变化图,反应放热△H=-553.75KJ/mol;则写出的热化学方程式为:C3H8(g)+5O2(g)=3CO2(g)+4H2O(l)△H1=-2215.0 kJ/mol,故答案为:C3H8(g)+5O2(g)=3CO2(g)+4H2O(l)△H1=-2215.0 kJ/mol;
②1mol二甲醚完全燃烧生成CO2和液态水放出1455kJ热量.若1mol丙烷和二甲醚的混合气体完全燃烧生成CO2和液态水共放出1645kJ热量,
设1mol混合气体中二甲醚物质的量x,丙烷物质的量为1-x,C3H8(g)+5O2(g)=3CO2(g)+4H2O(l);△H1=-2215.0 kJ/mol,得到丙烷燃烧放热(1-x)2215KJ;依据条件得到:1645KJ-1455xKJ=(1-x)2215KJ,计算得到x=0.75,则混合丙烷物质的量为0.25mol,则混合气体中丙烷和二甲醚物质的量之比=0.25:0.75=1:3,故答案为:1:3;
点评 本题考查了化学反应与能量、物质稳定性的判断,题目难度中等,注意把握盖斯定律的含义及其应用方法.


科目:高中化学 来源: 题型:选择题
| A. | 丙烷与氯气在光照的作用下的反应 | B. | 乙烯与溴的四氯化溶液的反应 | ||
| C. | 乙烯与水的反应 | D. | 乙烯自身生成聚乙烯的反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③⑤⑥ | B. | ②④⑥⑦ | C. | ②⑤⑦ | D. | 全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 微粒半径:Na+>K+>Cl->S2- | B. | 稳定性:HI>HBr>HCl>HF | ||
| C. | 酸性:HClO4>H2SO4>H3PO4>H2SiO4 | D. | 熔点:Al>Mg>Na>K |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| Al(OH)3 | Fe(OH)2 | Fe(OH)3 | |
| 开始沉淀时 | 3.4 | 6.3 | 1.5 |
| 完全沉淀时 | 4.7 | 8.3 | 2.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
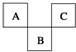 如图是周期表中短周期的一部分,A、B、C三种元素原子核外电子数之和等于B的质量数.B原子核内质子数和中子数相等.下面叙述中不正确的是( )
如图是周期表中短周期的一部分,A、B、C三种元素原子核外电子数之和等于B的质量数.B原子核内质子数和中子数相等.下面叙述中不正确的是( )| A. | 三种元素的原子半径的大小顺序是B<A<C | |
| B. | A元素最高价氧化物对应水化物具有强氧化性和不稳定性 | |
| C. | B元素的氧化物和氢化物的水溶液都呈酸性 | |
| D. | C元素的单质是非金属单质中唯一能跟水激烈反应的单质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 已知草酸氢钾溶液呈酸性,则在amol•L-1 KHC2O4溶液中,c(C2O42-)<c(H2C2O4) | |
| B. | 新制氯水中加入固体NaOH:c(Na+)=c(Cl-)+c(ClO-)+c(OH-) | |
| C. | 0.2mol/LCH3COOH溶液与0.1mol/LNaOH溶液等体积混合:2c(H+)-2c(OH-)=c(CH3COO-)-c(CH3COOH) | |
| D. | pH=3的盐酸和pH=3的FeCl3溶液中,水电离的c(H+)相等 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com