
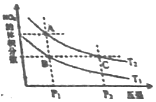
 反应N2O4(g)?2NO2(g)△H>0,在温度分别为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示,下列说法正确的是( )
反应N2O4(g)?2NO2(g)△H>0,在温度分别为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示,下列说法正确的是( )| A. | A、C两点的反应速率:A>C | |
| B. | A、C两点的化学平衡常数:A>C | |
| C. | A、C两点N2O4的转化率:A>C | |
| D. | 由状态B到状态A,可以用加热的方法 |
分析 N2O4(g)═2NO2(g))△H>0,该反应为吸热反应,升高温度,化学平衡正向移动,NO2的体积分数增大;增大压强,化学平衡逆向移动,NO2的体积分数减小,结合图象来分析解答.
解答 解:A.由图象可知,A、C两点都在等温线上,C的压强大,压强越大,速率越大,则A、C两点的反应速率:A<C,故A错误;
B.由图象可知,A、C两点都在等温线上,温度相同,则平衡常数相同,即化学平衡常数:A=C,故B错误;
C.由图象可知,A、C两点都在等温线上,C的压强大,平衡逆向移动,转化率减小,所以A、C两点N2O4的转化率:A>C,故C正确;
D.升高温度,化学平衡正向移动,NO2的体积分数增大,由图象可知,A点NO2的体积分数大,则T1<T2,由状态B到状态A,可以用加热的方法,故D正确;
故选:CD.
点评 本题考查化学平衡的图象,明确外界条件对化学平衡的影响及图象中纵横坐标的含义,然后利用“定一议二”、“先拐先平”的方法进行解答即可,难度不大.


科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 在化学反应中,反应物转化为生成物的同时,必然发生能量的变化 | |
| B. | 放热反应中,反应物的总能量大于生成物的总能量 | |
| C. | 放热反应发生时不一定要加热,但吸热反应必须要加热才能发生 | |
| D. | 断开化学键的过程会放出能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 准确称取0.4000 g NaOH固体可配成100 mL 0.1000 mol•L-1的NaOH标准溶液 | |
| B. | 催化剂可以加快化学反应速率但不能改变化学反应的焓变 | |
| C. | 100 mL pH=3的HA和HB分别与足量的锌反应,HB放出的氢气多,说明HB酸性比HA弱 | |
| D. | 对于反应2SO2(g)+O2(g)?2SO3(g),压缩气体体积使压强增大(其他条件不变),则SO2的转化率增大,平衡常数K也增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将1mL饱和氯化铁溶液逐滴加入到20mL温水中,边加边搅拌 | |
| B. | 向Fe(OH)3胶体中加入少量H2SO4溶液,会生成红褐色沉淀 | |
| C. | 可利用丁达尔效应区分胶体和溶液 | |
| D. | 胶体粒子具有较大的表面积,能吸附阳离子或阴离子,故在电场作用下会产生电泳现象 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com