
已知高温条件下2Al+Fe2O3=2Fe+Al2O3放出大量的热,据说可用于定向爆破和焊接铁轨。请问
①该反应中氧化剂是_____________,______________元素被氧化。
②标出该反应的电子转移方向和数目__________________________________。
③欲除去产物中的Al2O3,请写出所加试剂的离子反应方程式___________________________。
科目:高中化学 来源:2016届湖南省高三上学期月考化学试卷(解析版) 题型:选择题
25℃时,用0.1mol/L的CH3COOH溶液滴定20mL0.1 mol/L的NaOH溶液,当滴加VmLCH3COOH溶液时,混合溶液的pH=7。已知CH3COOH的电离平衡常数为Ka,忽略混合时溶液体积的变化,下列关系式正确的是
A.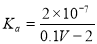 B.
B.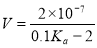 C.
C.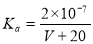 D.
D.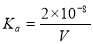
查看答案和解析>>
科目:高中化学 来源:2016届吉林省高三上四次模拟化学卷(解析版) 题型:选择题
某无色稀溶液X中,可能含有如表所列离子中的某几种。
阴离子 | CO32- 、SiO32-、AlO2- 、Cl- |
阳离子 | Al3+、Fe3+、Mg2+、NH4+ 、Na+ |
取该溶液适量,向其中加入某试剂Y,产生沉淀的物质的量(n)与加入试剂体积(V)的关系如图所示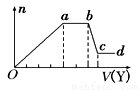 下列说法正确的是
下列说法正确的是
A.若Y是盐酸,则X中一定含有CO32-、SiO32-、AlO2-和Na+
B.若Y是NaOH溶液,则X中一定含有Al3+、Fe3+、NH4+、Cl-
C.若Y是NaOH溶液,则ab段发生反应的离子方程式为:NH4++OH-=NH3↑+H2O
D.若Y是NaOH溶液,则X中的Al3+、Mg2+、NH4+ 物质的量之比为1:1:2
查看答案和解析>>
科目:高中化学 来源:2016届陕西省高三上12月模拟化学试卷(解析版) 题型:选择题
下列离子方程式书写正确的是
A.氯化铝溶液中加入过量氨水:Al3+ + 4NH3·H2O=[Al(OH)4]- + 4NH4+
B.澄清石灰水与过量苏打溶液反应:Ca2+ + HCO3-+ OH-=CaCO3↓+ H2O
C.碳酸钙溶于醋酸:CaCO3 + 2H+=Ca2+ +CO2↑+ H2O
D.碘化亚铁中通入氯气:2I-+ Cl2=I2 + 2Cl-
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江西省宜春市高一上学期第三次月考化学试卷(解析版) 题型:填空题
焊接钢铁时常用的焊药为氯化铵,其作用是消除焊接处的铁锈。发生的反应体系中共有六种物质:NH4Cl、FeCl3、N2、Fe2O3、Fe和X。
(1)根据题意,可判断出X是 (写化学式);
(2)写出并配平该反应的化学方程式: ;
(3)发生还原反应的物质是 ,反应中2mol的氧化剂能___________(填“失去”或“得到”) mol电子。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年浙江省高一上学期12月月考化学试卷(解析版) 题型:选择题
下列离子在溶液中可以大量共存的一组是
A.H+、Na+、OH- B.Na+、NO3-、Cl-
C.K+、H+、HCO3- D.Ca2+、SO42-、CO32-
查看答案和解析>>
科目:高中化学 来源:2015-2016学年广西省高二上段考文化学试卷(解析版) 题型:选择题
某实验需要使用大约480mL 1mol/L的稀H2SO4,现若要你用18.4mol/L的浓H2SO4配制,则你需量取浓H2SO4的体积是
A.26.1mL B.27.2mL C.26.0m L D.27.0mL
查看答案和解析>>
科目:高中化学 来源:2015-2016年陕西西藏民族学院附属中学高二上期末化学卷(解析版) 题型:选择题
某同学按照课本实验要求,用50mL 0.50mol•L﹣1的盐酸与50mL 0.55mol•L﹣1的NaOH 溶液在如图所示的装置中进行中和反应.通过测定反应 过程中所放出的热量计算中和热.下列说法中,正确的是( )
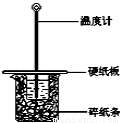
A.实验过程中没有热量损失
B.烧杯间填满碎纸条的作用是固定小烧杯
C.图中实验装置缺少环形玻璃搅拌棒
D.若烧杯上不盖硬纸板,测得的△H将偏小
查看答案和解析>>
科目:高中化学 来源:2016届河北省衡水市高三上一轮复习检测二化学试卷(解析版) 题型:填空题
I.氨是合成硝酸、铵盐和氮肥的基本原料,回答下列问题:
(1)氨的水溶液显弱碱性,其原因为 (用离子方程式表示),0.1 mol·L-1的氨水中加入少量的NH4Cl固体,溶液的PH (填“升高”或“降低”);若加入少量的明矾,溶液中的NH4+的浓度 (填“增大”或“减小”)。
(2)硝酸铵加热分解可得到N2O和H2O,250℃时,硝酸铵在密闭容器中分解达到平衡,该分解反应的化学方程式为 ,平衡常数表达式为 ;
Ⅱ.25℃,在0.10mol·L-1H2S溶液中,通入HCl气体或加入NaOH固体以调节溶液pH,溶液pH与c(S2-) 关系如右图(忽略溶液体积的变化、H2S的挥发)。

①pH=13时,溶液中的c(H2S)+c(HS-)= mol·L-1.
②某溶液含0.020 mol·L-1Mn2+、0.10 mol·L-1H2S,当溶液pH= 时,Mn2+开始沉淀。[已知:Ksp(MnS)=2.8×10-13]
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com