
【题目】把1mol X和1mol Y混合于2 L的密闭容器中,发生如下反应 2X(g)+Y(g) =nZ(g)
+2W(g),2min末X的物质的量为0.2mol,以Z的浓度表示的反应速率为0.1mol/(L·min)
请回答:
(1)前2min以X的浓度表示的平均反应速率
(2)n值
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】短周期元素W、X、Y、Z的原子序数依次增大,W与Y最外层电子数之和为X的最外层电子数的2倍,Z最外层电子数等于最内层电了数,X、Y、Z的简单离子的电子层结构相同,W的单质是空气中体积分数最大的气体。下列说法正确的是
A. Y的最高价氧化物对成水化物的酸性比W的强
B. W的气态氢化物比X的稳定
C. 离子半径的大小顺序:r(w)>r(X)>r(Y)>(Z)
D. XY2与ZY2中的化学键类型相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液中的氯离子浓度与50 mL 0.1 mol·L-1氯化铝溶液中氯离子的浓度相等的是( )
A.150 mL 0.1 mol·L-1 NaCl溶液
B.75 mL 0.2 mol·L-1 NH4Cl溶液
C.300 mL 0.1 mol·L-1 KCl溶液
D.150 mL 0.1 mol·L-1 FeCl3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子在溶液中因发生氧化还原反应而不能大量共存的是( )
A. H+、I-、Br2、Na+ B. Ag+、NO3-、Cl-、K+
C. K+、Ba2+、OH-、SO42- D. Cu2+、NH4+、Br-、OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在25℃时,2mol乙醇(C2H5OH)在氧气中完全燃烧放出的热量为2733.6kJ,写出表示乙醇燃烧热的热化学方程式 。
(2)利用乙醇的燃烧反应以氢氧化钠作电解质溶液设计一个燃料电池,则通入氧气的一极为 (填“正极”“负极”),负极的电极反应式为 。

(3)在如图所示装置中,石墨电极的电极反应式为 。如果开始加入的CuSO4足量,则电解一段时间,当电路中转移1.0mol电子时,要使溶液恢复至原浓度,可向其中加入的物质是 (填化学式),其质量为 g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列实验操作和现象所得到的结论正确的是
A.向NaAlO2溶液中通入足量CO2,有白色沉淀产生,说明碳酸的酸性强于氢氧化铝
B.用铂丝蘸取某溶液进行焰色反应,火焰呈黄色,说明溶液中不含有K+
C.在KI淀粉溶液中滴入氯水变蓝,再通入SO2,蓝色褪去,说明SO2具有漂白性
D.向某FeCl2溶液中,加入Na2O2粉末出现红褐色沉淀,说明原FeCl2已氧化变质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,反应N2(g)+O2(g)===2NO(g)在密闭容器中进行,下列措施不改变化学反应速率的是( )
A.缩小体积使压强增大 B.恒容,充入N2
C.恒容,充入He D.恒压,充入He
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分实验室用氢氧化钠固体配制1.0 mol·L-1的NaOH溶液250mL,回答下列问题:
(1)实验仪器:托盘天平、药匙、烧杯、玻璃棒、(量筒)、 。
(2)实验步骤:①计算:②称量,③溶解,④移液,⑤洗涤,⑥ ⑦摇匀。称量所需氯化钠的质量为 g。
(3)下列操作使所配溶液的浓度偏大的有________;
A.托盘天平的托盘放上纸称量NaOH |
B.未洗涤溶解NaOH的烧杯 |
C.溶解后未冷却就立即转移到容量瓶中 |
D.定容时俯视刻度线 |
E.摇匀,静置后发现液面不到刻度线,再加水至刻度线
F.容量瓶未干燥即用来配制溶液
(4)右图是实验步骤④的示意图,图中的错误是
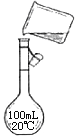
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com