
| A. | 1句 | B. | 2句 | C. | 3句 | D. | 4句 |
分析 ①共价化合物可能存在极性键、非极性键或都存在;
②离子键通过阴阳离子之间的相互作用形成,离子键没有方向性和饱和性,而共价键有方向性和饱和性;
③影响分子晶体熔、沸点的因素为氢键和相对分子质量;
④离子化合物的熔点不一定比共价化合物的熔点高;
⑤离子化合物形成的晶体一定是离子晶体,共价化合物形成的晶体一定是分子晶体;
⑥分子晶体中不一定含有共价键;
⑦含有极性键的分子不一定是极性分子,如四烷含极性键,但是非极性分子,含有非极性键的化合物可能是离子化合物,如过氧化钠中含有氧氧非极性键.
解答 解:①两种元素组成的共价化合物分子中也可能含有非极性键,如H2O2,故错误;
②离子键通过阴阳离子之间的相互作用形成,离子键没有方向性和饱和性,共价键是原子之间通过共用电子对形成,所以共价键有方向性和饱和性,故错误;
③影响分子晶体熔、沸点的因素为氢键和相对分子质量,所以相对分子质量大的熔、沸点不一定比相对分子质量小的高,例如水大于硫化氢,故错误;
④离子化合物的熔点不一定比共价化合物的熔点高,如二氧化硅的熔点大于NaCl的,故错误;
⑤离子化合物形成的晶体一定是离子晶体,共价化合物形成的晶体一定是分子晶体,故正确;
⑥分子晶体中不一定含有共价键,如稀有气体,而配位化合物中一定含有配位键,故正确;
⑦含有极性键的分子不一定是极性分子,如四烷含极性键,但是非极性分子,含有非极性键的化合物可能是离子化合物,如过氧化钠中含有氧氧非极性键,故正确;
综上所述3句正确,故选C.
点评 本题考查化学键,熟悉化学键形成的一般规律及常见物质中的化学键即可解答,并注意利用实例来解答,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | pH=1的一元酸和pH=13的一元碱等体积混合:c(OH-)=c(H+) | |
| B. | 0.1 mol/L的硫酸铵溶液中:c(SO42-)>c(NH4+)>c(H+)>c(OH-) | |
| C. | 0.1 mol/L的硫化钠溶液中:c(OH-)=c(H+)+c(HS-)+c(H2S) | |
| D. | 室温下,氢氧化钠与氯化铵的混合溶液的pH=7,则有c(Cl-)=c(NH4+)+c(Na+) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 氢氧化物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
| 开始沉淀的pH | 3.3 | 1.5 | 6.5 | 4.2 |
| 完全沉淀的pH | 5.2 | 3.7 | 9.7 | 6.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
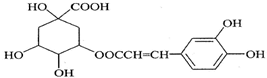
| A. | 分子式为C16H18O9 | |
| B. | 1 mol咖啡鞣酸水解时可消耗8molNaOH | |
| C. | 与苯环上碳直接相连的原子都在同一平面上 | |
| D. | 与浓溴水既能发生取代反应又能发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 元素在周期表中的位置,反映了元素的原子结构和元素的性质.下图是元素周期表的一部分.
元素在周期表中的位置,反映了元素的原子结构和元素的性质.下图是元素周期表的一部分. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 通过以下路线可合成(Ⅱ):
通过以下路线可合成(Ⅱ): $→_{△}^{浓H_{2}SO_{4}}$C3H4O2(Ⅲ)$\stackrel{C_{2}H_{5}OH/H+}{→}$C5H8O2$→_{一定条件}^{HBr}$(Ⅱ)
$→_{△}^{浓H_{2}SO_{4}}$C3H4O2(Ⅲ)$\stackrel{C_{2}H_{5}OH/H+}{→}$C5H8O2$→_{一定条件}^{HBr}$(Ⅱ) .
. ,反应类型是酯化反应(或取代反应).
,反应类型是酯化反应(或取代反应). .
.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | KClO3在反应中失去电子 | |
| B. | ClO2是氧化产物 | |
| C. | H2C2O4在反应中被氧化 | |
| D. | 1 mol KClO3参加反应有1 mol电子转移 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol/L Na2CO3溶液中含有0.2molNa+ | |
| B. | 在常温常压下,11.2L氮气所含的原子数目为NA | |
| C. | 2g氢气所含原子数目为NA | |
| D. | 在常温常压下,18 g水中含有的分子数为NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com