
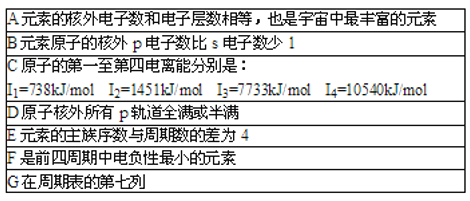
【题目】现有七种元素,其中A,B,C,D,E为短周期主族元素,F、G为第四周期元素,它们的原子序数依次增大.请根据下列相关信息,回答问题.
(1)已知BA5为离子化合物,写出其电子式__;
(2)B基态原子中能量最高的电子,其电子云在空间有_个方向,原子轨道呈_____形;
(3)某同学根据上述信息,推断C基态原子的核外电子排布为![]() 该同学所画的电子排布图违背了__;
该同学所画的电子排布图违背了__;
(4)G位于__族_区,价电子排布式为__;
(5)DE3中心原子的杂化方式为__,用价层电子对互斥理论推测其空间构型为__.
【答案】![]() 3 纺锤 泡利原理 ⅦB d 3d54s2 sp3 三角锥
3 纺锤 泡利原理 ⅦB d 3d54s2 sp3 三角锥
【解析】
根据元素周期表中原子结构排不规律分析解答;根据元素周期律分析解答;根据原子轨道杂化互斥理论分析解答;
A,B,C,D,E为短周期主族元素,F、G为第四周期元素,它们的原子序数依次增大,
A元素的核外电子数和电子层数相等,也是宇宙中最丰富的元素,A为H元素;B元素原子的核外p电子数比s电子数少1,B有2个电子层,为1s22s22p3,故B为N元素;由C原子的第一至第四电离能数据可知,第三电离能剧增,故C表现+2价,处于ⅡA族,原子序数大于N元素,故C为Mg元素;D处于第三周期,D原子核外所有p轨道全满或半满,最外层排布为3s23p3,故D为P元素;E处于第三周期,E元素的主族序数与周期数的差为4,E处于第ⅦA族,故E为Cl元素;F是前四周期中电负性最小的元素,F为第四周期元素,故F为K元素,G在第四周期周期表的第7列,G为Mn元素。
(1) BA5即NH5,电子式为:![]() ;
;
故答案为:![]() ;
;
(2)由于 B元素原子的核外p电子数比s电子数少1,B有2个电子层,为1s22s22p3,故B为N元素,N基态原子中能量最高的电子在p轨道上,其电子云在空间有3个方向,原子轨道呈纺锤形,故答案为:3;纺锤;
(3) 由表格信息可知,C原子的第一至第四电离能数据可知,第三电离能剧增,故C表现+2价,处于ⅡA族,原子序数大于N元素,故C为Mg元素,由图片可知,该同学的画的3s轨道违背了泡利不相容原理;
(4)根据题目信息可知,G在第四周期周期表的第7列,G为Mn元素,其位于ⅦB、d区,核外电子排布式为:[Ar] 3d54s2;故答案为:ⅦB;d;3d54s2
(5) DE3即PCl3,中心原子P的价能层电子对数为4,故其为sp3杂化,PCl3的价层电子对互拆模型为正四面体,3个成键电子对占据其3个杂化轨道,1个孤电子对占据余下的杂化轨道,故其空间构型为三角锥,故答案为:sp3;三角锥。


 状元坊全程突破导练测系列答案
状元坊全程突破导练测系列答案科目:高中化学 来源: 题型:
【题目】高纯硝酸锶[Sr(NO3)2]用于制造电视显像管、光学玻璃,也用于医药等。
I.工业硝酸锶中常含有硝酸钙、硝酸钡等杂质(硝酸钙可溶于浓硝酸,而硝酸锶、硝酸钡不溶于浓硝酸)。提纯硝酸锶的实验步骤如下:
①取含杂质的硝酸锶样品,__________,搅拌,过滤,并用浓HNO3洗涤滤渣。
②将滤渣溶于水中,加略过量(NH4)2Cr2O7(重铬酸铵),用氨水调节pH为7.5左右,使Ba2+沉淀,过滤。
③将滤液用硝酸调节pH为1时,慢慢加入H2C2O4·2H2O将过量的Cr2O72-还原为Cr3+,再用氨水调节pH=7,生成Cr(OH)3沉淀,过滤。
④将滤液用硝酸调节pH至2~3,蒸发浓缩,冷却结晶,过滤,洗涤。
⑤将得到的Sr(NO3)2·2H2O晶体在100 ℃条件下干燥,得到高纯硝酸锶。
(1)补充完整步骤①:
(2)步骤③中H2C2O4·2H2O将过量的Cr2O72-还原为Cr3+,同时产生一种无色无味的气体,写出该反应的离子方程式:__________。
(3)步骤③中生成的Cr(OH)3沉淀经处理后可以循环使用,方法是:一定条件下向Cr(OH)3中加入H2O2后,再加入氨水,即可得到(NH4)2Cr2O7(重铬酸铵)。请写出由Cr(OH)3生成(NH4)2Cr2O7的化学方程式:_____________。
(4)过氧化锶(SrO2·2H2O)制备原理:Sr(NO3)2+H2O2+2NH3·H2O=SrO2·2H2O↓+2NH4NO3。测得相同时间内 H2O2 的利用率随浓度的变化关系如图所示。5%的H2O2 比 20%的H2O2 的利用率低的原因是 _____________。

II.Sr(NO3)2受热易分解,生成Sr(NO2)2和O2;在500 ℃时,Sr(NO2)2进一步分解生成SrO及氮氧化物。取一定质量含Sr(NO2)2的Sr(NO3)2样品,加热至完全分解,得到10.40 g SrO固体和10.16 g混合气体。计算该样品中Sr(NO3)2的质量分数(请写出计算过程,结果精确到0.01)____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将V L HCl气体(标准状况),溶解在1 L水(水的密度为1 g/cm3)中,形成饱和溶液,所得溶液的密度为ρ g/mL,质量分数为ω,物质的量浓度为c mol/L,溶解度为s g,下列关系式不正确的是( )
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,向圆底烧瓶中加入1 molC2H5OH和含1molHBr的氢溴酸,溶液中发生反应;C2H5OH+HBr![]() C2H5Br+H2O,充分反应后达到平衡。已知常压下,C2H5Br和C2H5OH的沸点分别为38.4℃和78.5℃。下列有关叙述错误的是
C2H5Br+H2O,充分反应后达到平衡。已知常压下,C2H5Br和C2H5OH的沸点分别为38.4℃和78.5℃。下列有关叙述错误的是
A. 加入NaOH,可增大乙醇的物质的量
B. 增大HBr浓度,有利于生成C2H5Br
C. 若反应物增大至2 mol,则两种反应物平衡转化率之比不变
D. 若起始温度提高至60℃,可缩短反应达到平衡的时间
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2和O3组成的混合气体的质量为14.0g,其中碳原子与氧原子的物质的量之比是1:8。计算:
①该混合气体中CO2 的物质的量是______?
②标准状况下,该混合气体的体积是______?
③该混合气体的平均摩尔质量是______?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】妈妈教小鲁蒸馒头:先用酵头发面,面团发酵至两倍大后,再加纯碱调节酸性,然后将面团揉切后上锅蒸即可。小鲁查阅资料得知,酵头可使面团在微生物作用下产生CO2气体,从而使面团疏松,但同时也会产生乳酸、醋酸等有机酸。
(1)下列关于纯碱的认识正确的是___。
A.受热易分解 B.水溶液显碱性 C.属于碱 D.可与酸反应
(2)小鲁探究用Na2CO3调节面团酸度,而不用NaHCO3的原因。
①Na2CO3与NaHCO3质量均为1g时,消耗H+的物质的量更多的是___。
②以Na2CO3或NaHCO3为例,计算消耗H+的物质的量,写出计算过程。___
(3)小鲁实际操作时,发现面团发得不好,面团内的气孔少,略有酸味。妈妈指导小鲁将Na2CO3改用NaHCO3,继续揉面,上锅蒸后果然蒸出了松软的馒头。解释NaHCO3的作用___。
(4)某品牌复合膨松剂的说明书如图所示。

其中葡萄糖酸-δ-内酯和淀粉是助剂,其作用是防止膨松剂吸潮结块而失效。焦磷酸二氢二钠的作用是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在硫酸铜晶体结晶水含量测定的实验中,会造成实验结果偏低的是( )
A. 加热时间过长,固体部分变黑B. 坩埚内附有不挥发杂质
C. 晶体不纯,含有不挥发杂质D. 加热过程中有少量晶体溅出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】容积不变的密闭容器中发生反应:2SO2(g)+O2(g) ![]() 2SO3(g);ΔH<0,某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,下列对于图像分析正确的是
2SO3(g);ΔH<0,某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,下列对于图像分析正确的是

A. 图Ⅰ研究的是t0时刻增大O2的物质的量浓度对反应速率的影响
B. 图Ⅱ研究的是t0时刻通入氦气增大体系压强对反应速率的影响
C. 图Ⅲ研究的是温度对化学平衡的影响,且乙的温度较高
D. 图Ⅲ研究的是催化剂对化学平衡的影响,且甲的催化效率比乙高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苹果醋是一种由苹果发酵而形成的具有解毒、降脂、减肥等明显药效的健康食品。苹果酸(2-羟基丁二酸)是这种饮料的主要酸性物质,苹果酸的结构简式为![]() ,下列相关说法不正确的是( )
,下列相关说法不正确的是( )
A. 苹果酸在一定条件下能发生酯化反应
B. 苹果酸在一定条件下能发生催化氧化反应
C. 苹果酸能与钠、镁等活泼金属发生置换反应生成H2
D. 1mol苹果醋与Na2CO3溶液反应一定消耗2molNa2CO3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com